某化合物的化学式可表示为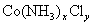 (x、y为正整数)。为了确定x和y的值,取两份质量均为0.2140g的该化合物进行如下两个实验。将一份试样溶于水,在硝酸存在的条件下用
(x、y为正整数)。为了确定x和y的值,取两份质量均为0.2140g的该化合物进行如下两个实验。将一份试样溶于水,在硝酸存在的条件下用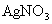 溶液滴定(生成
溶液滴定(生成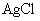 沉淀),共消耗24.0mL 0.100mol/L的
沉淀),共消耗24.0mL 0.100mol/L的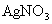 溶液。在另一份试样中加入过量
溶液。在另一份试样中加入过量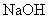 溶液并加热,用足量盐酸吸收逸出的
溶液并加热,用足量盐酸吸收逸出的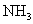 。吸收
。吸收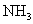 共消耗24.0mL 0.200mol/L
共消耗24.0mL 0.200mol/L 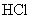 溶液。试通过计算确定该化合物的化学式。(本题可能用到的相对原子质量:H为1.00、N为14.0、Cl为35.5、Co为58.9)
溶液。试通过计算确定该化合物的化学式。(本题可能用到的相对原子质量:H为1.00、N为14.0、Cl为35.5、Co为58.9)
过氧化钠与铝粉混合物共18.3g,加入100mL 水,充分反应后混合物完全溶解,并收集到5.6L气体。(标准状况)
(1)收集到的气体成份是,体积比是。
(2)计算反应后溶液中各溶质的物质的量浓度。(设溶液体积不变)
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ·mol-1、-283.0kJ·mol-1和-726.5kJ·mol-1。
请回答下列问题:
(1)用太阳能分解10mol水消耗的能量是_____________kJ;
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为;
(3)在溶积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变得情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃);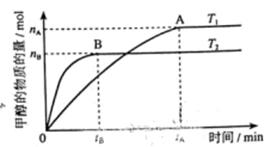
下列说法正确的是________(填序号)
①温度为T1时,从反应开始到平衡,生成甲醇的平均速率为:v(CH3OH)=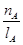 mol·L-1·min-1
mol·L-1·min-1
②该反应在T1时的平衡常数比T2时的小
③该反应为放热反应
④处于A点的反应体系从T1变到T2,达到平衡时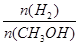 增大
增大
(4)在T1温度时,将1molCO2和3molH2充入一密闭恒容器中,充分反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为______;
(8分)向甲乙两个容积均为1 L的恒容容器中,分别充入2 mol A、2 mol B和1 mol A、1 mol B。相同条件下(温度T ℃),发生下列反应:A(g)+B(g) xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示:
xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示:
回答下列问题:
(1)乙容器中,平衡后物质B的转化率________;
(2)x=________;
(3)T ℃时该反应的平衡常数为________;
(4)下列说法正确的是________。
A.向平衡后的乙容器中充入氦气可使c(A)增大
B.将乙容器单独升温可使乙容器内各物质的体积分数与甲容器内的相同
C.若向甲容器中再充入2 mol A、2 mol B,则平衡时甲容器中0.78 mol·L-1<c(A)<1.56 mol-1
把物质的量均为0.1mol的AlCl3、CuCl2和H2SO4溶于水制成100 mL的混合溶液,用石墨做电极电解,并收集两电极所产生的气体,一段时间后在两极收集到的气体在相同条件下体积相同。则
(1)两个电极均可收集到的气体在标准状况下的体积为L;
(2)电路中共转移mol电子;
(3)铝元素最终的存在形式为。
(6分)利用盖斯定律解答下列各小题
(1)已知反应:H2(g)+ O2(g)==H2O(g)△H1 N2(g)+2O2==2NO2(g)△H2
O2(g)==H2O(g)△H1 N2(g)+2O2==2NO2(g)△H2 N2(g)+
N2(g)+ H2(g)==NH3(g)△H3
H2(g)==NH3(g)△H3
利用上述三个反应,计算4NH3(g)+7O2(g)==4NO2(g)+6H2O(g)的反应焓变为(用含△H1、△H2、△H3的式子表示)。
(2) 已知:CH4(g)+H2O(g)===CO(g)+3H2(g)ΔH=+206.2 kJ·mol-1
CH4(g)+CO2(g)===2CO(g)+2H2(g)ΔH=+247.4 kJ·mol-1
则以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为:。