在AlCl3和FeCl3混合溶液中,先加入过量的KI溶液,再加入足量的Na2S溶液,所得到的沉淀物是( )
| A.Fe(OH)3、Al(OH)3 | B.Al(OH)3、I2 |
| C.Fe2S3、I2 | D.FeS、S、Al(OH)3 |
下列说法中,正确的有( )
(1)明矾可用于水的消毒净化;碳酸钡不可用于钡餐透视
(2)氮氧化物和碳氢化合物是构成光化学烟雾的重要物质
(3)氨常用作制冷剂,是因为其沸点极低,很容易液化
(4)硅的提纯与应用,促进了半导体元件与集成芯片的发展,可以说“硅是信息技术革命的催化剂”
(5)在硫酸亚铁铵的制备实验中,为了得到硫酸亚铁铵晶体,应小火加热蒸发皿,直到有大量晶体析出时停止加热
(6)通电时,溶液中溶质粒子分别向两极移动,胶体中胶粒向某一极移动
(7)铝粉和氧化镁粉末混合,高温能发生铝热反应
(8)高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遭遇强碱会“断路”
(9)可用稀盐酸、碳酸钠溶液、硅酸钠溶液设计实验来验证氯、碳、硅三种元素的非金属性
(10)同主族元素的简单阴离子还原性越强,水解程度越大
(11)Al2O3在工业上用于制作耐高温材料,也用于电解法治炼铝
(12)在硫酸铜结晶水含量测定实验中,至少要用天平称量三次质量
(13)将水蒸汽通过灼热的铁粉,粉末变红,说明铁在高温条件下可与水发生化学反应
(14)先取少量试液于试管中,再加入氢氧化钠溶液,将润湿的红色石蕊试纸放在试管口,红色石蕊试纸不变蓝,证明溶液中不含铵根离子。
(15)已知次磷酸(H3PO2)是一元中强酸,则NaH2PO2是正盐
| A.8句 | B.6句 | C.5句 | D.7句 |
正丁醛经催化加氢可制备1-丁醇。为提纯含少量正丁醛杂质的1-丁醇,现设计如下路线:
已知:①正丁醛与饱和NaHSO3溶液反应可生成沉淀;②乙醚的沸点是34℃,难溶于水,与1-丁醇互溶;③1-丁醇的沸点是118℃。则操作1~4分别是( )
| A.萃取、过滤、蒸馏、蒸馏 | B.过滤、分液、蒸馏、萃取 |
| C.过滤、蒸馏、过滤、蒸馏 | D.过滤、分液、过滤、蒸馏 |
X、Y、Z、W四种物质的转化关系如图所示。下列组合中不符合该关系的是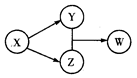
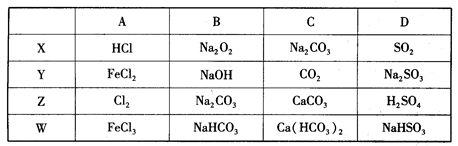
下列有关几种常见的金属和非金属及其化合物的说法正确的是( )
| A.铝热反应是指铝能将所有的金属从其氧化物中置换出来 |
| B.Na、Mg、Al、Fe、Cu都能导电,它们的氧化物都能与酸反应 |
| C.CO2、NO、SO2都是非金属氧化物,都属于酸性氧化物 |
D.CaCO3+SiO2 CaSiO3+CO2↑的发生,说明硅酸的酸性强于碳酸 CaSiO3+CO2↑的发生,说明硅酸的酸性强于碳酸 |
安全是顺利进行实验及避免伤害的保障.下列实验操作正确且不是从实验安全角度考虑的是( ) 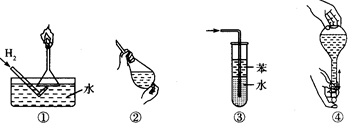
| A.操作①:使用稍浸入液面下的倒扣漏斗检验氢气的纯度 |
| B.操作②:使用CCl4萃取溴水中的溴时,振荡后需打开活塞使漏斗内气体放出 |
| C.操作③:吸收氨气或氯化氢气体并防止倒吸 |
| D.操作④:用食指顶住瓶塞,另一只手托住瓶底,把瓶倒立,检查容量瓶是否漏水 |