莫尔盐[(NH4)2Fe(SO4)2·6H2O]常作氧化还原滴定法的基准物质,下列有关该盐溶液的比较,不正确的是( )
A.c(SO )>c(NH )>c(NH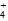 )>c(Fe2+)>c(H+)>c(OH-) )>c(Fe2+)>c(H+)>c(OH-) |
B.c(SO )=c(NH )=c(NH )>c(Fe2+)>c(H+)>c(OH-) )>c(Fe2+)>c(H+)>c(OH-) |
C.2c(SO )+c(OH-)=c(NH )+c(OH-)=c(NH )+2c(Fe2+)+c(H+) )+2c(Fe2+)+c(H+) |
D.c(NH )+c(NH3·H2O)=2c(Fe2+)+2c[Fe(OH)2] )+c(NH3·H2O)=2c(Fe2+)+2c[Fe(OH)2] |
下列说法正确的是( )
| A.25℃时 NH4Cl 溶液的 KW大于 100℃时 NaCl 溶液的 KW |
B.SO2通入碘水中,反应的离子方程式为 SO2+I2+2H2O=SO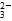 +2I-+4H+ +2I-+4H+ |
C.加入铝粉能产生 H2的溶液中,可能存在大量的 Na+、Ba2+、AlO 、NO 、NO |
| D.100℃时,将 pH =2 的盐酸与 pH =12 的 NaOH 溶液等体积混合,溶液显中性 |
将pH=6的CH3COOH溶液加水稀释1000倍后,溶液中的( )
| A.pH=9 | B.c(OH-)≈10-5 mol·L-1 |
| C.pH≈7 | D.c(OH-)<10-7 mol·L-1 |
氨水中存在下列的电离平衡:NH3·H2O NH
NH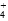 +OH-要使平衡向左移动,同时使OH-离子浓度增大,应加入下列的( )
+OH-要使平衡向左移动,同时使OH-离子浓度增大,应加入下列的( )
| A.NaOH固体 | B.NH4Cl固体 |
| C.H2SO4 | D.H2O |
高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数:
| 酸 |
HClO4 |
H2SO4 |
HCl |
HNO3 |
| Ka |
1.6×10-5 |
6.3×10-9 |
1.6×10-9 |
4.2×10-10 |
从以上表格中判断以下说明不正确的是( )
A.在冰醋酸中这四种酸都没有完全电离
B.在冰醋酸中高氯酸是这四种酸中最强的酸
C.在冰醋酸中硫酸的电离方程式为H2SO4=2H++SO
D.水对于这四种酸的强弱没有区分能力,但醋酸可以区分这四种酸的强弱