在0.1 mol·L-1明矾溶液100 mL中,加入0.1 mol·L-1的Ba(OH)2溶液,当SO42-恰好沉淀完全时,同时得到的氢氧化铝的物质的量为( )。
| A.0.01 mol | B.0.005mol | C.0.0133 mol | D.0 mo1 |
下列变化规律错误的是
| A.微粒半径:F – < Cl – < Br – < I – | B.稳定性:HI< HBr <HCl< HF |
| C.沸点:HF< HCl < HBr< HI | D.阴离子还原性:F – < Cl – < Br – < I – |
下列叙述中正确的是(NA为阿伏加德罗常数)
| A.通常状况下将0.5mol HI气体和0.5 mol Cl2混合后,气体的分子数小于NA |
| B.同温同压下,相同体积的物质,其物质的量必相等 |
| C.5.3g Na2CO3固体含有的离子数为1.5NA |
| D.标准状况下,0.5 NA个Br2所占的体积约为11.2L |
如图所示是短周期的一部分,已知B原子与C 原子核外电子总数 之和为A的4倍,则下列推断正确的是
之和为A的4倍,则下列推断正确的是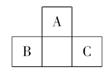
A.A、B、C三者中,A为金属性元素,B、C为非金属性元素
B.A、B、C三者核电荷数之和为40
C.A与B、A与C均可形成离子化合物 D.B与C只能形成一种共价化合物
有a、b、c、d、e五种气体,进行下列实验:
| (1)a和b混合 |
气体变红棕色 |
| (2)c和d混合 |
产生白烟 |
| (3)c和e分别通入少量溴水中 |
溴水都变成无色透明的液体 |
| (4)b和e分别通入氢硫酸中 |
都产生淡黄色浑浊 |
a、b、c、d、e依次可能是
A.O2、NO、HCl、NH3、CO2 B.O2、NO、NH3、HCl、SO3
C.NO、O2、NH3、HCl、SO2 D.HCl、CO2、NH3、H2S、CH4
根据相关的化学原理,下列判断正确的是
A.由于水中存在氢键,所以稳定性:H2O >H2S >H2S |
B.由于二氧化硅的相对分子质 量比二氧化碳的大,所以沸点:SiO2>CO2 量比二氧化碳的大,所以沸点:SiO2>CO2 |
| C.若A2 + 2D— ="=" 2A— + D2,则氧化性D2>A2 |
| D.若R2—和M+的电子层结构相同,则离子半径R2—>M+ |