某水体中含有较多的泥沙及其他悬浮物,下列物质不能用来净化此水的是( )
| A.NaCl | B.Fe2(SO4)3 | C.KAl(SO4)2 | D.KOH |
已知:25°C时,Ksp﹝Mg(OH)2﹞=5.61×10-12,Ksp﹝MgF2﹞=7.42×10-11。下列说法正确的是
| A.25°C时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大 |
| B.25°C时,Mg(OH)2固体在20 ml 0.01 mol/L氨水中的Ksp比在20 mL 0.01 mol/L NH4Cl溶液中的小 |
| C.25°C时,在Mg(OH)2的悬浊液加入NaF溶液后,Mg(OH)2不可能转化成为MgF2 |
| D.25°C时,在Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大 |
在两个容积均为1 L密闭容器中以不同的氢碳比[n(H2)/n(CO2)]充入H2和CO2,在一定条件下发生反应:2CO2(g) + 6H2 (g) C2H4(g) + 4H2O(g) ΔH。CO2的平衡转化率
C2H4(g) + 4H2O(g) ΔH。CO2的平衡转化率
α(CO2)与温度的关系如下图所示。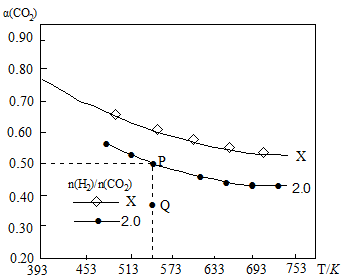
下列说法正确的是
| A.该反应的ΔH > 0 |
| B.氢碳比:X< 2.0 |
| C.在氢碳比为2.0时,Q点v(逆)小于P点的v(逆) |
| D.P点温度下,反应的平衡常数为512 |
25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是
| A.pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合: c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| B.0.1mol·L-1CH3COONa溶液与0.1mol·L-1CH3COOH溶液等体积混合(pH=4.75): c (CH3COO-) + c (CH3COOH) =" 2" c(Na+) |
| C.0.1mol·L-1CH3COONa溶液与0.1mol·L-1 HCl溶液混合至pH=7: c(Na+)>c(Cl-) = c(CH3COOH)>c(CH3COO-) |
| D.0.1mol·L-1 Na2CO3溶液与0.1mol·L-1 NaHCO3溶液等体积混合: |
c (HCO3-) + 2c (H+) + 3c (H2CO3) = c(CO32-) + 2c(OH-)
根据下列实验现象所得结论正确的是
| 选项 |
实验 |
现象 |
结论 |
| A |
将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液 |
有气体生成,溶液未呈血红色 |
稀硝酸不能将Fe氧化为Fe3+ |
| B |
向NaAlO2溶液中滴入NaHCO3溶液 |
产生白色沉淀 |
AlO2-结合H+的能力比CO32-强 |
| C |
已知Cu2O + 2H+ = Cu2+ + Cu + H2O 将氢气还原氧化铜后所得红色固体 投入足量稀盐酸 |
溶液呈蓝色 |
CuO的还原产物不全部是Cu |
| D |
将0.1 mol·L-1 MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1 mol·L-1CuSO4溶液 |
先有白色沉淀生成,后变为浅蓝色沉淀 |
Cu(OH)2的溶度积比Mg(OH)2的大 |
下列设计的实验方案能达到实验目的的是
| A.制备干燥的NH3:加热浓氨水,将生成的气体通过盛有浓硫酸的洗气瓶 |
| B.提纯含有少量HCl的CO2:将混合气体依次通过盛有饱和碳酸钠溶液、浓硫酸的洗气瓶 |
| C.检验食盐中是否含有碘酸钾:取少量的食盐溶液,加稀硫酸酸化,再滴入淀粉溶液,观察实验现象 |
| D.探究温度对化学平衡移动的影响:将盛有NO2和N2O4混合气体的烧瓶,先后置于冷水和热水中,观察烧瓶中气体颜色的变化 |