已知KNO3、Cu(NO3)2、AgNO3三种硝酸盐热分解的反应方程式如下(条件都是加热):
①2KNO3=2KNO2+O2↑
②2Cu(NO3)2=2CuO+4NO2↑+O2↑
③2AgNO3=2Ag+2NO2↑+O2↑
今有某固体可能由上述三种硝酸盐中的一种或几种组成。取适量该固体充分加热,得到一定量的气体,将这些气体通入水中,结果全部被吸收,没有剩余,回答:
(1)该固体是否可能只由一种盐组成?若可能,指出是哪种盐,若不可能,说明原因。___________________________________________________________________________________.
(2)若固体是混合物,指出它的可能组成(即物质的量之比),若没有这种组成,也请说明__________________________________________________________________________________。
实验室制取并收集氯气的装置如右图:某同学进行实验时可能有如下操作: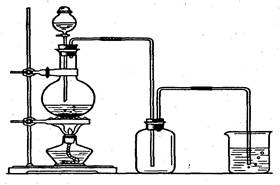
(1)烧瓶中发生反应的化学方程式是:___________________________。
(2)制得的氯气可选用____________来干燥,烧杯中发生反应的离子方程式是_________________。
(3)在实验室里,常用加热食盐晶体和浓硫酸的混合物的方法来制取HCl,HCl是一种无色有刺激性气味的气体,密度比空气大,极易溶于水,它的水溶液叫氢氯酸,即盐酸。
①实验室制取HCl的发生装置可选用制_____的发生装置(填O2、Cl2、CO2中的一种)。
②收集氯化氢气体时应采用__________法。
③实验室可用__________________________试纸放在瓶口检验HCl是否充满了集气瓶。
④上图哪些装置可作为多余氯化氢的吸收装置?______________________________。
(共9分)已知NaAlO2+HCl+H2O=Al(OH)3↓+NaCl,某混合物A含有
KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化: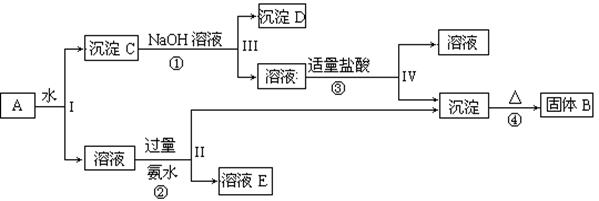 据此回答下列问题:
据此回答下列问题:
(1)I、II、III、IV四步中对于溶液和沉淀的分离采取的方法是。
(2)根据上述框图反应关系,写出下列B、D所含物质的化学式
固体B;沉淀D;
(3)写出①、②、④四个反应的化学方程式,是离子反应的写出离子方程式
①;
②;
④ 。
。
(共12分)在容积固定为2L的密闭容器中,充入0.180 molHI,480℃时反应:
2HI(g) H2(g)+I2(g),体系中n(HI)随时间变化情况如下表:
H2(g)+I2(g),体系中n(HI)随时间变化情况如下表:
| t/min |
0 |
2 |
4 |
6 |
8 |
10 |
| n(HI)/mol |
0.180 |
0.164 |
0.152 |
0.144 |
0.140 |
0.140 |
反应进行至10min后将反应混合物的温度降低,发现气体的颜色变浅。
(1)0~2min内H2的平均反应速度为。达平衡时,HI的转化率是_________。(2)上述正向反应是:反应(选填:放热、吸热)。
(3)某温度下上述反应平衡时,恒容、升高温度,原化学平衡向反应方向移动(填“正”或“逆”),正反应速率(填“增大”、“减小”或“不变”),容器内混合气体的压强(填“增大”、“减小”或“不变”)。
(4)480℃时,反应H2(g)+I2(g) 2HI(g)的平衡常数K的值为。
2HI(g)的平衡常数K的值为。
(5)要增大反应2HI(g) H2(g)+I2(g)的平衡常数,可采取的措施是(选填字母)。
H2(g)+I2(g)的平衡常数,可采取的措施是(选填字母)。
A.增大HI起始浓度
B.向混合气体中通入I2
C.使用高效催化剂
D.升高温度
某同学应用如图所示的方法研究物质的性质,其中气体a的主要成分是氯气,杂质是空气和水蒸气。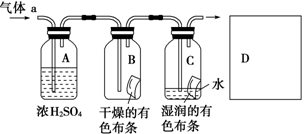
(1)该实验的主要目的是__________________________________。
(2)浓硫酸的作用是_____________________________________,
与研究目的直接相关的实验现象是________________________。
(3)从物质性质的方面来看,这样的实验设计存在着事故隐患,事故隐患表现是_____________________________________________,
请在图中D框中以图的形式表明克服事故隐患的措施
(1)Na2CO3固体中混有少量的NaHCO3固体,除去的方法是,
(2)除去铁粉中混有的少量铝粉,可选用试剂:;采取方法分离。
(3)除去FeCl2溶液中少量的FeCl3,可选用试剂。
写出离子方程式。