设C+CO2==2CO;△H>0,反应速率为v1;N2+3H2==2NH3;△H<0,反应速率为v2,对于上述反应,当温度升高时,v1和v2的变化情况为……( )
| A.同时增大 | B.同时减小 | C.v1增大,v2减小 | D.v1减小,v2增大 |
通常人们把拆开1 mol 某化学键所吸收的能量看成该化学键的键能。键能的大小可用于估算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
| 化学键 |
A—A |
B—B |
A—B |
| 生成1 mol化学键时放出的能量 |
436 kJ·mol-1 |
243 kJ·mol-1 |
431 kJ·mol-1 |
则下列热化学方程式不正确的是()
A.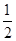 A2(g)+
A2(g)+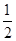 B2(g)=AB(g)ΔH=-91.5 kJ·mol -1
B2(g)=AB(g)ΔH=-91.5 kJ·mol -1
B.A2(g)+B2(g)=2AB(g)ΔH=-183 kJ·mol -1
C.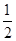 A2(g)+
A2(g)+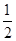 B2=AB(g)ΔH=+91.5 kJ·mol-1
B2=AB(g)ΔH=+91.5 kJ·mol-1
D.2AB(g)=A2(g)+B2(g)ΔH=+183 kJ·mol-1
钛被称为“第三金属”,其制取原料为金红石(TiO2),制取步骤为:
TiO2→TiCl4 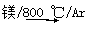 Ti
Ti
已知:①C(s)+O2(g)=CO2(g) ,ΔH1
②2CO(g)+O2(g)=2CO2(g) ,ΔH2
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) ,ΔH3
则反应TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的ΔH为
| A.ΔH3+2ΔH1+2ΔH2 | B.ΔH3+2ΔH1+ΔH2 |
| C.ΔH3+2ΔH1-ΔH2 | D.ΔH3+2ΔH1-2ΔH2 |
合成氨的反应是:N2(g)+3H2(g) 2NH3(g);△H<0。使产率增大的方法是
2NH3(g);△H<0。使产率增大的方法是
| A.升高温度 | B.降低压强 | C.使用催化剂 | D.及时分离出NH3 |
下列说法正确的是
| A.HCl和NaOH反应的中和热△H=-57.3kJ/mol,则1mol H2SO4和1mol Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol |
| B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)= 2CO(g)+O2(g)反应的△H=+(2×283.0)kJ/mol |
| C.需要加热才能发生的反应一定是吸热反应 |
| D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
下列事实,不能用勒夏特列原理解释的是
A.溴水中有平衡:Br2+ H2O  HBr+ HBrO 加入 AgNO3溶液后,溶液颜色变浅 HBr+ HBrO 加入 AgNO3溶液后,溶液颜色变浅 |
B.对CO(g) + NO2 (g)  CO2(g)+ NO(g) 平衡体系增大压强可使颜色变深 CO2(g)+ NO(g) 平衡体系增大压强可使颜色变深 |
| C.升高温度能够增大硝酸钾在水中的溶解度 |
| D.合成 NH3反应,为提高 NH3的产率,理论上应采取相对较低温度的措施 |