完全相同的两个容器A和B,已知:A中SO2和O2各1g;B中装有SO2和O2各2g;在同温度下反应达到平衡时,A中SO2的转化率为a%,B中SO2的转化率为b%。则A、B两容器SO2的转化率关系正确的是……( )
A、a%>b% B、a%=b% C、a%<b% D、无法确定
下列反应中,不属于取代反应的是()
A. |
B. |
C. |
D. |
下列关于化学反应限度的说法中正确的是()
| A.当一个可逆反应达到平衡状态时,就是这个反应在该条件下所能达到的限度 |
| B.当一个可逆反应进行到平衡状态时,这个反应的正向反应速率和逆向反应速率为零 |
| C.平衡状态是一种静止的状态,因为反应物和生成物的浓度不再改变 |
| D.化学反应的限度不可以通过改变条件而发生改变 |
在密闭容器中,存在反应: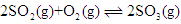 ,下列可使化学反应速率增大的措施是()
,下列可使化学反应速率增大的措施是()
A.减小 浓度 浓度 |
B.升高温度 | C.增大容器体积 | D.降低温度 |
在温度不变的条件下,在恒容的容器中进行下列反应: 。若
。若 的浓度由
的浓度由 降到
降到 需要15s,那么
需要15s,那么 的浓度由
的浓度由 降到
降到 所需的反应时间()
所需的反应时间()
| A.等于5s | B.等于10s | C.大于10s | D.小于10s |
在反应 中,表示该反应速率最快的是()
中,表示该反应速率最快的是()
A. |
B. |
C. |
D. |