CO无色无味有毒,世界各国每年均有不少人因CO中毒而失去生命。一种CO分析仪的工作原理如右图所示,该装置中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动。下列说法错误的是()
| A.负极的电极反应式为:CO+O2—―2e-=CO2 |
| B.工作时电极b作正极,O2-由电极a流向电极b |
| C.工作时电子由电极a通过传感器流向电极b |
| D.传感器中通过的电流越大,尾气中CO的含量越高 |
X、Y、Z是原子序数依次递增的短周期元素,3种元素的原子核外电子数之和与Ca2+的核外电子数相等,X、Z分别得到一个电子后均形成稀有气体原子的稳定电子层结构。下列说法正确的是
| A.原子半径:Z>Y>X |
| B.Z与X形成化合物的沸点高于Z的同族元素与X形成化合物的沸点 |
| C.Na2Y2与水发生氧化还原反应时,Na2Y2只作氧化剂 |
| D.CaX2、CaY2和CaZ2等3种化合物中,阳离子与阴离子个数比均为1︰2 |
下列实验现象及相关的离子方程式均正确的是()
| A.碳酸钙粉末中加入醋酸溶液,固体质量减小,生成无色气体 CaCO3 + 2H+=Ca2+ + CO2↑ + H2O |
| B.向BaCl2溶液中通入SO2气体,出现白色沉淀:Ba2+ + SO2 + H2O = BaSO3↓ + 2H+ |
| C.向H2O2溶液中滴加酸化的KMnO4溶液,KMnO4溶液褪色 2MnO4- + 7H2O2 + 6H+ = 2Mn2+ + 6O2↑ + 10H2O |
| D.将等物质的量浓度、等体积的Ba(OH)2溶液和NaHSO4溶液混合,生成白色沉淀 |
Ba2+ + SO42- + H+ + OH-= BaSO4↓ + H2O
某化学反应的能量变化如图所示。下列有关叙述正确的是()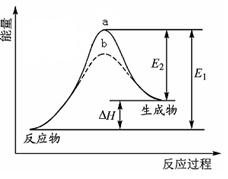
| A.该反应的反应热△H=E2-E1 |
| B.a、b分别对应有催化剂和无催化剂的能量变化 |
| C.催化剂能降低反应的活化能 |
| D.催化剂能改变反应的焓变 |
下列化学实验事实及其结论都正确的是()
| 选项 |
实验事实 |
结论 |
| A |
将SO2通入含HClO的溶液中生成H2SO4 |
HClO的酸性比H2SO4强 |
| B |
铝箔在酒精灯火焰上加热熔化但不滴落 |
铝箔表面氧化铝熔点高于铝 |
| C |
SiO2可以和NaOH溶液及HF溶液反应 |
SiO2属于两性氧化物 |
| D |
将SO2通入溴水中,溴水褪色 |
SO2具有漂白性 |