某学生将氯乙烷与NaOH溶液共热几分钟后,冷却,滴入AgNO3溶液,结果未见到白色沉淀生成,其主要原因是( )
| A.加热时间太短 |
| B.不应冷却后再加入AgNO3 |
| C.加AgNO3溶液前未用稀HNO3酸化 |
| D.反应后的溶液中不存在Cl- |
下列有机物中既能发生加成反应,又能发生酯化反应,还能被新制Cu(OH)2悬浊液氧化的物质是( )
| A.CH2=CH-CHO | B.CH3CH2COOH |
| C.CH2=CH-COOCH3 | D.CH2OH(CHOH)4CHO |
已知酸性: >H2CO3>
>H2CO3> ,综合考虑反应物的转化率和原料成本等因素,将
,综合考虑反应物的转化率和原料成本等因素,将 转变为
转变为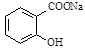 的最佳方法是( )
的最佳方法是( )
| A.与稀H2SO4共热后,加入足量NaOH溶液 |
| B.与稀H2SO4共热后,加入足量NaHCO3溶液 |
| C.与足量的NaOH溶液共热后,再通入足量CO2 |
| D.与足量的NaOH溶液共热后,再加入适量H2SO4 |
在核磁共振氢谱中出现两组峰,其氢原子数之比为3∶2的化合物是( )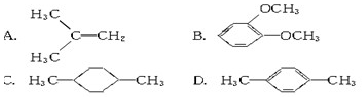
已知C—C键可以绕键轴自由旋转,结构简式如下的烃,下列说法中正确的是( )
| A.分子中至少有8个碳原子处于同一平面上 |
| B.分子中至少有9个碳原子处于同一平面上 |
| C.该烃的一氯取代物最多有8种 |
| D.该烃是苯的同系物 |
11.2L甲烷、乙烷、甲醛组成的混合气体,完全燃烧后生成15.68LCO2(气体体积均在标准状况下测定),混合气体中乙烷的体积百分含量为( )
| A.20% | B.40% | C.60% | D.80% |