在AgNO3、KNO3、Cu(NO3)2的混合溶液中,加入一定量的铁粉,充分反应后,有少量金属析出,过滤后,往滤液中滴加盐酸,有白色沉淀生成,则析出的金属是……( )
| A.Cu和Ag | B.Cu | C.Ag | D.K |
(双选)LiFePO4电池具有稳定性高、安全、对环境友好等优点,可用于电动汽车。电池反应为:FePO4+Li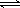 LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含Li+导电固体为电解质。下列关于LiFePO4电池的说法正确的是()
LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含Li+导电固体为电解质。下列关于LiFePO4电池的说法正确的是()
| A.可加入硫酸以提高电解质的导电性 |
| B.放电时电池内部Li+向负极移动 |
| C.充电过程中,电池正极材料质量减少 |
| D.放电时电池正极反应为:FePO4+Li++e-===LiFePO4 |
下列热化学方程式正确的是(ΔH的绝对值均正确)()
| A.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(g) ΔH=-1 367.0 kJ·mol-1(标准燃烧热) |
| B.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=+57.3 kJ·mol-1(中和热) |
| C.S(s)+O2(g)===SO2(g) ΔH=-296 kJ·mol-1(反应热) |
| D.2NO2===O2+2NO ΔH=+116.2 kJ·mol-1(反应热) |
下列关于盐酸和醋酸两种稀溶液的说法正确的是()
| A.相同浓度的两溶液中c(H+)相同 |
| B.100 mL 0.1 mol·L-1的两溶液能中和等物质的量的氢氧化钠 |
| C.pH=3的两溶液稀释100倍,pH都为5 |
| D.两溶液中分别加入少量对应的钠盐,c(H+)均明显减小 |
对水的电离平衡不产生影响的粒子是()
| A.HCl | B.CH3COO- | C.Fe3+ | D.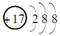 |
在2A+B===3C+4D的反应中,下列表示该反应的化学反应速度最快的是()
A.v(A)=0.5 mol·L-1·s-1
B.v(B)=0.3 mol·L-1·s-1
C.v(C)=0.8 mol·L-1·s-1
D.v(D)=1.0 mol·L-1·s-1