粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物。进行如下实验:
①取适量A进行铝热反应,产物中有单质B生成;
②另取20 g A全部溶于0.15 L 6.0 mol/L盐酸中,得溶液C;
③将①中得到的单质B和溶液C反应,放出1.12 L(标准状况)气体,同时生成溶液D,还残留有固体物质B;
④用KSCN溶液检验时,溶液D不变色。
请回答:
(1)①中引发铝热反应的实验操作是_____________________________________,产物中的单质B是________________。
(2)②中所发生的各反应的化学方程式是_____________________________________。
(3)③中所发生的各反应的离子方程式是______________________________________。
(4)若溶液D的体积仍视为0.15 L,则该溶液中c(Mg2+)为________,c(Fe2+)为_______。
A、B两元素,A的原子序数为x,A、B所在周期元素的种类分别为m和n,若A、B同在第ⅠA族,当B在A的上周期时,B的原子序数为________,当B在A的下周期时,B的原子序数为________;若A、B同在第ⅦA族,当B在A的上周期时,B的原子序数为________,当B在A的下周期时,B的原子序数为________。
元素周期表中前7周期的元素种类如下表所示:
| 周期数 |
一 |
二 |
三 |
四 |
五 |
六 |
七 |
| 元素种类 |
2 |
8 |
8 |
18 |
18 |
32 |
32 |
(1)第六、七周期比第四、五周期多了14种元素,其原因是_________________________________________。
(2)周期表中_______族所含元素最多,_______族元素形成化合物最多。
(3)请分析周期数与元素种类的关系,然后预言第八周期最多可能含有的元素种类为()
A.18 B.32
C.50 D.64
(4)居里夫人发现的镭是元素周期表中第七周期第ⅡA族元素,下列关于镭的性质的描述中不正确的是()
A.在化合物中呈+2价
B.氢氧化物呈两性
C.单质能使水分解,放出氢气
D.碳酸盐难4溶于水
元素周期表是学习和研究化学的重要工具。下列是元素周期表的部分信息: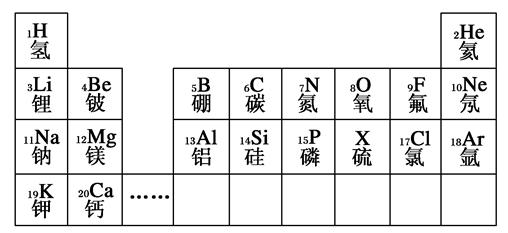
(1)地壳中含量最多的金属元素的原子序数是________。
(2)分析上表规律,可推知,表中X为________。
(3) 表示的是(写粒子符号)________。
表示的是(写粒子符号)________。
(4)写出一个由1、7、17号三种元素组成的化合物的化学式:________________________________________________________________________。
A、B、C为短周期元素,在周期表中所处的位置如图所示。A、C两元素的原子核外电子数之和等于B原子的质子数。B原子核内质子数和中子数相等。
(1)A、B、C三种元素的名称分别为__________、________、________。
(2)B位于元素周期表中第________周期第________族。
(3)C的原子结构示意图为________,C的单质与H2反应的化学方程式为_______________________________________________________________________。
(4)写出A的气态氢化物与B的最高价氧化物对应水化物反应的化学方程式__________________________________________________________。
化学反应原理在科研和生产中有广泛应用。
(1)利用“化学蒸气转移法”制备TaS2晶体,发生如下反应:
TaS2(s)+2I2(g) TaI4(g)+S2(g) ΔH>0(I)
TaI4(g)+S2(g) ΔH>0(I)
反应(Ⅰ)的平衡常数表达式K=________,若K=1,向某恒容容器中加入1 mol I2(g)和足量TaS2(s),I2(g)的平衡转化率为________。
(2)如图所示,反应(Ⅰ)在石英真空管中进行,先在温度为T2的一端放入未提纯的TaS2粉末和少量I2(g),一段时间后,在温度为T1的一端得到了纯净TaS2晶体,则温度T1________T2(填“>”“<”或“=”)。上述反应体系中循环使用的物质是________。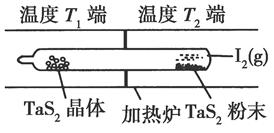
(3)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢样中的硫转化成H2SO3,然后用一定浓度的I2溶液进行滴定,所用指示剂为________,滴定反应的离子方程式为______________________。
(4)25℃时,H2SO3 HSO3-+H+的电离常数Ka=1×10-2mol·L-1,则该温度下NaHSO3水解反应的平衡常数Kh=________mol·L-1,若向NaHSO3溶液中加入少量的I2,则溶液中
HSO3-+H+的电离常数Ka=1×10-2mol·L-1,则该温度下NaHSO3水解反应的平衡常数Kh=________mol·L-1,若向NaHSO3溶液中加入少量的I2,则溶液中 将________(填“增大”“减小”或“不变”)。
将________(填“增大”“减小”或“不变”)。