已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是……( )
| A.H2O(g)=H2(g)+1/2 O2(g) △H=+242kJ·mol-1 | B.2H2(g)+ O2(g)= 2H2O(l) △H=-484kJ·mol-1 |
| C.H2(g)+ 1/2 O2(g)= H2O(g) △H=+242kJ·mol-1 | D.2H2(g)+ O2(g)= 2H2O(g) △H=+484kJ·mol-1 |
某单烯烃和氢气完全加成后得到的饱和烃是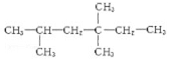 ,该烯烃可能有的结构有
,该烯烃可能有的结构有
| A.2种 | B.3种 | C.4种 | D.5种 |
将有机物的混合物在一定条件下反应:①甲醇与乙醇的混合物与浓硫酸加热得醚;②乙烷与氯气光照下取代;③氨基乙酸和丙氨酸生成二肽;④苯和液溴、Fe粉反应。所生成的有机物的种类由多到少的顺序是
| A.③②④① | B.③②①④ | C.②③①④ | D.①②③④ |
下图表示4-溴环己烯所发生的4个不同反应,其中产物只含有一种官能团的反应是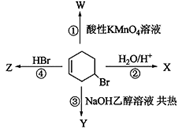
| A.①② | B.②③ | C.③④ | D.①④ |
某中性有机物C8H16O2在稀硫酸作用下加热得到M和N两种物质,N经氧化最终可得到M,则该中性有机物的结构可能有
| A.1种 | B.2种 | C.3种 | D.4种 |
在一定条件下,将A、B、C三种炔烃所组成的混合气体4g在催化剂作用下与过量的氢气发生加成反应,可生成4.4g对应的三种烷烃,则所得烷烃中一定有
A.戊烷 B.丁烷 C.丙烷 D.乙烷