0℃,1.01×105Pa时,分别向甲、乙、丙三个容器中加入30.0mL同浓度的盐酸,
| 反应容器 |
甲 |
乙 |
丙 |
|
| 加入合金质量(g) |
0.510 |
1.53 |
3.57 |
|
| 与盐酸反应生成气体(L) |
0.560 |
0.672 |
0.672 |
|
| 与氢氧化钠反应产生气体(L) |
0.336 |
x |
y |
|
再加入不同质量的由两种金属组成的合金粉末,测量放出气体的体积。若在甲、乙、丙三个容器中加入与盐酸同体积同浓度的氢氧化钠溶液,再分别加入与上述实验相同质量的同种合金,测量放出气体的体积,如下表:
根据表中数据可以计算得出的是_________;
A.合金的组成 B.合金中组分的含量
C.盐酸的物质的量浓度 D.盐酸的密度
能计算出的量的值为__________________;
(2)若两种金属是下列选项中的某两种,则从甲容器中的两次实验:
①不经计算,肯定没有________________(填字母符号);
A.40Ca B.56Fe C.64Cu D.24Mg E.27Al
②通过计算讨论推测合金的成分____________;
(3)根据(2)的推测结果,计算x和y的值分别为多少?
下列各物质互为同位素的是;互为同素异形体的是;互为同系物的是;互为同分异构体的是_____________;互为同一物质的是
| A.CH2=CH2和CH2=CH—CH=CH2 |
| B.C4H8和C6H12 |
| C.O2和O3 |
D. |
E. 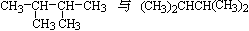
F. C2H6和C4H10G.16O 、18O
H. 金刚石和石墨
I. CH3(CH2)3CH3和(CH3)2CHCH2CH3
J.CH3CH2CH2CH(C2H5)CH3和CH3CH2CH2CH(CH3)C2H5
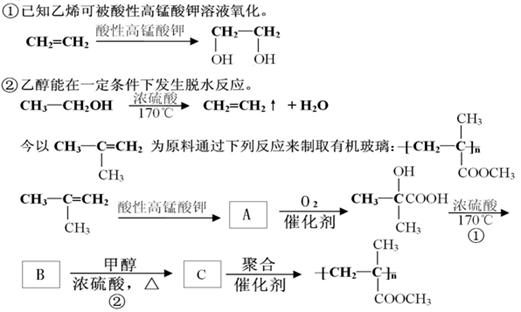
(1)请写出上面方框内的有机物的结构简式
A.B.C.
(2)写出反应①和反应②的化学方程式及反应类型:
反应①:;反应类型
反应②:;反应类型
(3)写出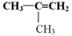 的链状结构的同分异构体中两种物质的结构简式;;
的链状结构的同分异构体中两种物质的结构简式;;
某物质A的产量可以用来衡量一个国家的石油化工发展水平。其与水加成的产物B是一种常用的有机溶剂,在生活中有重要的应用。
(1) A的电子式为________,B的分子式为________。
若用B与O2制成燃料电池,并以稀硫酸溶液为电解质溶液,回答(2)-(5)题:
(2)负极上的电极反应式为_______________________________________。
(3)消耗标准状况下的5.6 L O2时,有__________mol电子发生转移。
(4)开始放电时,正极附近溶液的pH__________(填“增大”、“减小”或“不变”);
(5)溶液中H+由___________区向__________区移动(填“正极”或“负极”)。
现有10种元素的性质、数据如下表所列,它们均为短周期元素。回答下列问题:
| A |
B |
C |
D |
E |
F |
G |
H |
I |
J |
|
| 原子半径(10-9m) |
0.074 |
0.160 |
0.152 |
0.110 |
0.099 |
0.186 |
0.075 |
0.082 |
0.102 |
0.037 |
| 最高或最低 化合价 |
+2 |
+1 |
+5 |
+7 |
+1 |
+5 |
+3 |
+6[ |
+1 |
|
| -2 |
-3 |
-1 |
-3 |
-2 |
(1)H的元素符号是; B在元素周期表中的位置是(周期、族)
(2)在以上元素形成的最高价氧化物的水化物中,酸性最强的化合物的分子式是。
(3)化合物F2A2的电子式是:,构成该物质的化学键类型为________________(填“离子键、极性键或非极性键”)
当F2A2与J2A的反应中有3.01×1023个电子转移时,参加反应的F2A2的质量是g。
(4)用电子式表示J2A的形成过程:;
根据图示回答下列问题: 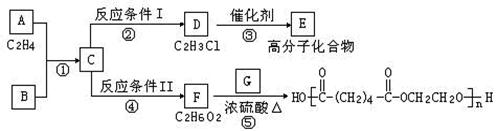
(1)写出G的结构简式:;
(2)反应③的化学方程式是,
反应④的化学方程式是;
(3)写出②、⑤的反应类型:②、⑤。