今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100 mL溶液进行如下实验:(1)第一份加入AgNO3溶液有白色沉淀产生;(2)第二份加足量NaOH溶液加热后,收集到气体0.04 mol;(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。根据上述实验,以下推测正确的是 ( )

| A.K+一定不存在,SO42-一定存在 | B.100 mL溶液中含0.02mol CO32- |
C.Cl-一定不存在,CO32-一定存在 | D.Ba2+一定不存在,Mg2+可能存在 |
a g铜粉与足量硝酸共热,完全反应后生成b L(标准状况下)气体,则被还原的硝酸不可能是()
A.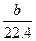 mol mol |
B.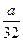 mol mol |
C.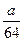 mol mol |
D.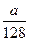 mol mol |
向1 L 0.5 mol·L-1的H2SO4溶液中加入10.1 g KNO3和12.8 g Cu,充分反应后产生的气体在标准状况下的体积为()
| A.2.24 L | B.3.36 L | C.4.48 L | D.5.60 L |
下图为两个连通容器,中间用活塞分开,左、右两室各充入一定量NO和O2,且恰好使两容器内气体密度相同。打开活塞,使NO与O2充分反应,最终容器内混合气体密度与原来相比()
| A.增大 | B.减小 | C.不变 | D.无法确定 |
下列试剂必须用棕色试剂瓶装的有()
①浓氨水②氯水③硝酸银④浓硝酸⑤浓盐酸⑥溴化银
| A.①②③④⑤⑥ | B.②③④⑥ | C.②③⑤⑥ | D.①③④⑥ |
把含有(NH4)2SO4、NH4NO3的混合溶液a L分为两等份,一份加b mol KOH刚好使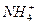 全部转化为NH3,另一份加入c mol BaCl2溶液恰好沉淀完全,则原混合溶液中
全部转化为NH3,另一份加入c mol BaCl2溶液恰好沉淀完全,则原混合溶液中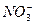 的浓度是()
的浓度是()
A. mol·L-1 mol·L-1 |
B.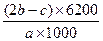 % % |
C.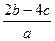 mol·L-1 mol·L-1 |
D.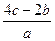 mol·L-1 mol·L-1 |