取一定量铁粉和硫粉的混合物,隔绝空气加热使其充分反应,冷却后再加入足量的稀H2SO4,产生2.24 L气体(标准状况下)。则下列说法正确的是 ( )

| A.2.24 L气体的质量一定小于或等于3.4 g | B.原混合物中一定含有5.6 gFe |
C.原混合物的质量不可能大于8.8 g | D.原混合物加热反应后的物质肯定是纯净物 |
糖类、脂肪和蛋白质是维持人体生命活动所必需的三大营养物质,以下叙述正确的是()
| A.淀粉、纤维素没有甜味,因此不属于糖类 |
| B.油脂属于酯类化合物,油脂的水解反应叫皂化反应 |
| C.葡萄糖能发生氧化反应和水解反应 |
| D.浓硝酸溅在皮肤上,使皮肤呈黄色是由于浓硝酸和蛋白质发生了颜色反应 |
下列化学用语的书写正确的是()
| A.乙酸的分子式:C2H4O2 | B.乙醇的结构简式:C2H6O |
C.F原子结构示意图: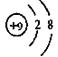 |
D.四氯化碳的电子式: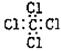 |
可逆反应2NO2(g)  2NO(g) + O2(g),在体积不变的密闭容器中进行,达到平衡状态的标志是()
2NO(g) + O2(g),在体积不变的密闭容器中进行,达到平衡状态的标志是()
①单位时间内生成n molO2的同时生成2n molNO2
②单位时间内生成n molO2的同时生成2n molNO
③NO2、NO、O2的物质的量浓度比值为2∶2∶1 ④混合气体的颜色不再改变
⑤混合气体的密度不再改变 ⑥混合气体的总压强不再改变
| A.①④⑥ | B.②③⑤ | C.①③④ | D.全部 |
把A、B、C、D4块金属片浸入稀硫酸中,用导线两两相连组成原电池。若A、B相连时,A为负极;C、D相连时,D上产生大量气泡;A、C相连时,电流由C经导线流向A;B、D相连时,电子由D经导线流向B,则此4种金属的活动性由强到弱的顺序为()
A.A>B>C>D B.A>C>D>BC.C>A>B>D D.B>A>C>D
下列关于元素周期表和元素周期律的说法错误的是( )
| A.Li、Na、K元素的原子核外电子层数随着核电荷数的增加而增多 |
| B.第二周期元素从Li到F,非金属性逐渐减弱 |
| C.Na和Cs属于第ⅠA族元素,Cs失电子能力比Na的强 |
| D.O与S为同主族元素,且O比S的非金属性强 |