向50mL 18mol/LH2SO4溶液中加入足量的铜片并加热。充分反应后,被还原的H2SO4的物质的量 ( )

| A.小于0.45mol | B.等于0.45mol | C.在0.45mol和0.90mol之间 | D.大于0.90mol |
某温度时,BaSO4在水中的沉淀溶解平衡:BaSO4(s)  Ba2+(aq)+SO42-(aq) Ksp=c(Ba2+)·c(SO42-),沉淀溶解平衡曲线如图所示。下列说法正确的是
Ba2+(aq)+SO42-(aq) Ksp=c(Ba2+)·c(SO42-),沉淀溶解平衡曲线如图所示。下列说法正确的是
| A.b点时c(Ba2+)·c(SO42-)小于Ksp |
| B.a点对应的Ksp等于c点对应的Ksp |
| C.加水稀释可以使溶液由b点变到c点 |
| D.加入适量的Na2SO4不可能使溶液由a点变到c点 |
室温下,某溶液中由水电离产生的c(H+)、c(OH-)满足c(H+)·c(OH-)=10-24,则下列各组离子在该溶液中可能大量共存的是
| A.NH4+、Fe2+、NO3-、SO42- |
| B.Ba2+ 、Na+、Cl-、NO3- |
| C.Na+、Cl-、SO42-、HCO3- |
| D.HCO3-、Na+、AlO2-、Cl- |
水的电离平衡为H2O 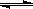 H+﹢OH-,△H>0,下列叙述不正确的是
H+﹢OH-,△H>0,下列叙述不正确的是
| A.将水加热,pH减小 |
| B.恒温下,向水中加入少量固体KOH,Kw不变 |
| C.向水中滴入稀醋酸,c(H+)增大 |
| D.向水中加入少量固体NaClO,平衡逆向移动 |
在0.10mol·L-1NH3·H2O溶液中,加入少量NH4Cl晶体后,引起的变化是
| A.NH3·H2O的电离程度减小 | B.NH3·H2O的电离常数增大 |
| C.溶液的导电能力不变 | D.溶液的pH增大 |
如图为直流电源电解稀Na2SO4水溶液的装置。通电后在石墨电极a和b附近分别滴加一滴石蕊试液,下列实验现象中正确的是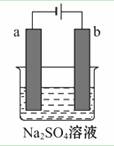
| A.逸出气体的体积a电极的小于b电极的 |
| B.一电极逸出无味气体,另一电极逸出刺激性气味气体 |
| C.a电极附近呈红色,b电极附近出现蓝色 |
| D.a电极附近呈蓝色,b电极附近出现红色 |