

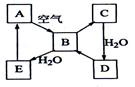
 下图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去)。化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料。
下图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去)。化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料。
 (1)写出A在加热条件下与H2反应的化学方程式
(1)写出A在加热条件下与H2反应的化学方程式
 _________________________________________________。
_________________________________________________。
 (2)写出E与A的氢化物反应生成A的化学方程式 。
(2)写出E与A的氢化物反应生成A的化学方程式 。
 (3)写出一个由D生成B的化学方程式 ______________________。
(3)写出一个由D生成B的化学方程式 ______________________。
 (4)将5mL0.10mol·L-1的E溶液与10mL0.10 mol·L-1的NaOH溶液混合。
(4)将5mL0.10mol·L-1的E溶液与10mL0.10 mol·L-1的NaOH溶液混合。
 ①写出反应的离子方程式________________________;
①写出反应的离子方程式________________________;
 ②反应后溶液的pH ______7(填“大于”、“小于”或“等于”),理由是________;
②反应后溶液的pH ______7(填“大于”、“小于”或“等于”),理由是________;
 ③加热反应后的溶液,其pH________(填“增大”、“不变”或“减小”),理由是________________________________。
③加热反应后的溶液,其pH________(填“增大”、“不变”或“减小”),理由是________________________________。
(1)配平可逆反应: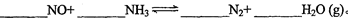
已知400℃时,1.6 mol NO和NH3混合气体发生以上反应达到平衡后,混合气体的物质的量变为1.7 mol,则被氧化的N的物质的量为。
(2)已知某温度下0.01 mol/L盐酸溶液中水电离的c(H+)="l" x 10-11mol/L,则Kw=;若在此温度下将pH==a的NaOH溶液与pH=b的盐酸按1:100体积刚好完全反应,a、b应满足关系为。
(3)有一种白色固体,可能含有CaCO3、Ba(N O3)2、NH4 C1、KCl、A gN O3、Al2(SO4)3
和KMnO4中的一种或几种。①将白色固体用水溶解并过滤,②将滤渣加入足量盐酸中,滤渣全部溶解并放出气体;③向滤液中加入足量浓NaOH溶液,加热,放出能使湿润红色石蕊试纸变蓝的气体,待溶液冷却后,继续滴入适量的稀盐酸,有白色沉淀产生。则该白色固体中一定有,可能有。
(1)3.320 g该羧酸中碳原子的物质的量为______;
(2)列式计算3.320 g该羧酸中氢、氧原子的物质的量H______mol、O______mol;
(3)该羧酸中C、H、O的原子数之比为______;
(4)写出符合以上各条件的相对分子质量最小的芳香族羧酸的结构简式。
(1)参加反应的氧气质量是__________。生成CO2的质量是_________。
(2)有机物A的通式可表示为____________。
(3)写出相对分子质量最小的下列A的结构简式:①能发生银镜反应的,②能与Na2CO3反应的_____________,③具有果香味的_____________,④能和CuO反应的__________,⑤具有正四面体结构的________________________。
把含有HCl和H2SO4各18 mmol的混合酸 100 mL,加热浓缩至1 mL,最后剩余液体是___________,其物质的量浓度为___________。
把AlCl3(aq)蒸干灼热,最后得到的固体产物是什么?(用化学方程式表示,并配以必要的文字说明)。