
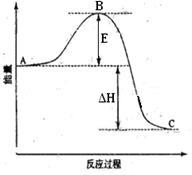




 2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的
2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的
ΔH=-99kJ·mol-1.请回答下列问题:

 (1)图中A、C分别表示 、 ,E的大小对该反应的反应热有无影响? 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ,理由是 ;
(1)图中A、C分别表示 、 ,E的大小对该反应的反应热有无影响? 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ,理由是 ;

 (2)图中△H= KJ·mol-1;
(2)图中△H= KJ·mol-1;

 (3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式 ;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式 ;

 (4)如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)= mol·L-1·min-1、υ(SO3)= mol·L-1·min-1;
(4)如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)= mol·L-1·min-1、υ(SO3)= mol·L-1·min-1;

 (5)已知单质硫的燃烧热为296 KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H (要求计算过程)。
(5)已知单质硫的燃烧热为296 KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H (要求计算过程)。
含有1mol HNO3的稀硝酸溶液与铁粉反应,所得氧化产物a、b的物质的量与加入铁粉物质的量关系如图所示(其中p、q、r为氧化产物的物质的量,n1、 n2、n3为加入铁粉的物质的量)。请回答以下问题: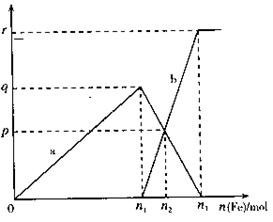
(1)氧化产物a是________ b是_______
(2)P=___________________
(3)n1="________" n2=_________
写出(2)、(3)计算过程:
硫酸和盐酸组成的混合液100 mL,与3.42g氢氧化钡粉末恰好完全反应后溶液呈中性。反应后经过滤、洗涤、干燥,得到沉淀2.33g。则分别计算原混合液中硫酸和盐酸的物质的量的浓度。(设溶液总体积始终不变)
( 6分)标准状况下,0.1mol某烃完全燃烧燃烧后,产生17.92升二氧化碳气体和9克水。该烃不能与溴水反应,但可使酸性高锰酸钾溶液褪色,则:
(1)此烃的分子式为。
(2)该烃硝化时,一硝基取代物仅一种,则该烃的结构简式为。
(3)该烃硝化时,一硝基取代物有3种,则该烃的结构简式为。
由碳棒,铁片和200mL 1.5mol/L的稀硫酸组成的原电池中,当在碳棒上产生气体3.36L(标准状况)时,则:
①总电池反应的离子方程式为。
②有mol电子通过了电线?
③此时溶液中H+的物质的量浓度为(不考虑溶液体积变化)。
(1)已知某反应的各物质浓度数据如下:


起始浓度( ): 1.5 1.0 0
): 1.5 1.0 0
2s末浓度( ): 0.9 0.8 0.4
): 0.9 0.8 0.4
则①a=,b=。
②2S内B的反应速率=。