下列离子方程式的书写正确的是
| A.实验室用浓盐酸与MnO2反应制Cl2: MnO2 +4HCl(浓)  Cl2↑+Mn2+ +2Cl-+2H2O Cl2↑+Mn2+ +2Cl-+2H2O |
| B.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全: Ba2++2OH—+H++ SO42—+ NH4+ =BaSO4↓+ NH3·H2O +H2O |
| C.向NaOH溶液中滴加同浓度的少量Ca(HCO3)2溶液: Ca2++ HCO3—+OH—=CaCO3↓+H2O |
| D.铜溶于稀硝酸:3Cu + 8H+ + 2NO3-= 3Cu2+ + 2 NO↑+ 4H2O |
下列有关杂化轨道的说法中错误的是
| A.ⅠA族元素成键时不可能有杂化轨道 |
| B.s轨道和p轨道不可能有sp4出现 |
| C.杂化轨道既可能形成σ键,也可能形成π键 |
| D.孤对电子有可能参加杂化 |
主族元素X的原子最外电子层中具有最多的未成对电子,元素Y的原子只有两种形状的电子云,且两种电子云的电子数相等,则X、Y组成的微粒中,不可能存在的是
| A.X2Y5 | B.XY42- | C.XY2- | D.XY3- |
下列分子中的中心原子杂化轨道的类型相同的是
| A.SO3与SO2 | B.BF3与NH3 |
| C.BeCl2与SCl2 | D.C2H2与C2H4 |
以下有关元素性质的说法不正确的是
| A.具有下列电子式的原子中,①1s22s22p63s23p2②1s22s22p3③1s22s22p2④1s222s2p63s23p4,原子半径最大的是① |
| B.下列原子的价电子排布中,①3s23p1②3s23p2③3s23p3④3s23p4,对应的第一电离能最大是③ |
| C.①Na,K,Rb②N,P,As③O,S,Se④Na,P,Cl元素的电负性随原子序数增大而递增的是④ |
| D.某元素的逐级电离能分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时可能生成的阳离子是X3+ |
塑料奶瓶中存在有双酚A(如图),欧盟认为含双酚A奶瓶会诱发性早熟,从2011年3月2日起,禁止含生产双酚A(BPA)的婴儿奶瓶。关于双酚A的下列说法正确的是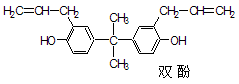
A.双酚A分子中所有碳原子有可能在一个平面上
B.双酚A分子式为C21H22O2
C.双酚不能发生聚合反应
D.1 mol双酚A最多可与4 mol 浓溴水发生取代反应