相同物质的量的下列有机物,充分燃烧,消耗氧气量相同的是
| A.C3H4和C2H6 | B.C3H6和C3H8O |
| C.C3H6O2和C3H8O | D.C3H8O和C4H6O2 |
课堂学习中,同学们利用镁条、锌片、铜片、导线、电流计、橙汁、烧杯等用品探究原电池的组成。下列结论错误的是
| A.原电池是将化学能转化成电能的装置 |
| B.原电池由电极、电解质溶液和导线等组成 |
| C.上图中a极为镁条、b极为锌片时,导线中会产生电流 |
| D.上图中a极为锌片、b极为铜片时,电子由铜片通过导线流向锌片 |
下图是配制一定物质的量浓度溶液的过程示意图。下列说法中错误的是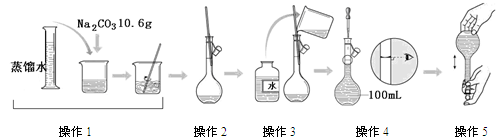
| A.所配制的Na2CO3溶液的物质的量浓度为1.0 mol/L |
| B.操作2是将溶解的Na2CO3溶液转移到容量瓶中 |
| C.操作4是滴加水至溶液凹液面的最低点与刻度线平齐 |
| D.操作5中,定容摇匀后发现液面低于刻度线,要继续加水至液面与刻度线平齐 |
实验是化学研究的基础。下列对实验现象的描述错误的是
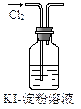 |
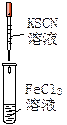 |
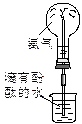 |
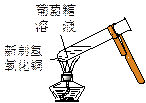 |
||||
| ① |
② |
③ |
④
|
在含有较多NH4+、Ba2+、NO3ˉ、Clˉ的溶液中还能大量共存的离子是
| A.Ag+ | B.Mg2+ | C.SO42ˉ | D.OHˉ |
在用海带提取碘的实验中,进行萃取和分离操作时要用到的仪器是
| A.蒸发皿 | B.烧瓶 | C.漏斗 | D.分液漏斗 |