晶体硅是一种重要的非金属材料。制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl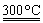 SiHCl3+H2
SiHCl3+H2
③SiHCl3与过量H2在1 000~1 100 ℃反应制得纯硅
已知SiHCl3能与H2O强烈反应,在空气中易自燃。
请完成下列问题:
(1)第①步制备粗硅的化学反应方程式为________________。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0 ℃)中含有少量SiCl4(沸点57.6 ℃)和HCl(沸点-84.7 ℃),提纯SiHCl3采用的方法为:________________。
(3)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):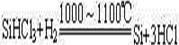
①装置B中的试剂是________,装置C中的烧瓶需要加热,其目的是:________________。
②反应一段时间后,装置D中观察到的现象是________________________,装置D不能采用普通玻璃管的原因是________________,装置D中发生反应的化学方程式为________________________。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及________________________________。
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是________。
a.碘水 b.氯水 c.NaOH溶液 d.KSCN溶液 e.Na2SO3溶液
一定温度下,向1.0L密闭容器中加入0.60molX(g),发生反应X(g)  Y(s)+2Z(g)△H>0测得反应物X浓度与反应时间的数据如下表
Y(s)+2Z(g)△H>0测得反应物X浓度与反应时间的数据如下表
| 反应时间t/min |
0 |
1 |
2 |
3 |
4 |
6 |
8 |
| c(X)/(mol·L-1) |
0.60 |
0.42 |
0.30 |
0.21 |
0.15 |
a |
0.0375 |
(1)3min时用Z表示的平均反应速率v(Z)=。
(2)分析该反应中反应物的浓度与时间的规律,得出的结论是。由此规律推出反应在6min时反应物的浓度a为mol·L-1。
(3)反应的逆反应速率随时间变化的关系如图,t2时改变了某一种条件,改变的条件可能是、(填写两顶)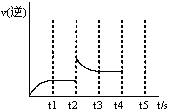
(4)下列哪些情况表明容器中已达平衡状态(填字母序号)
A.容器体积一定时气体密度不再变化
B.反应的平衡常数不再变化
C.容器中气体的平均相对分子质量不随时间而变化
D.Y的物质的量不再发生变化
E.Z的生成速率等于X的消耗速率的2倍
下表给出了五种元素的相关信息,其中w、X、Y、Z为短周期元素,原子序数依次递增。
| 元素 |
相关信息 |
| W |
单质为密度最小的气体 |
| X |
元素最高正价与最低负价之和为0 |
| Y |
工业上通过分离液态空气获得其单质,该单质的某种同素异形体是保护地球地表环境的重要屏障 |
| Z |
存在质量数为23,中子数为12的核素 |
| T |
金属单质为红色,导电性好,是人体不可缺少的徽量元素,焰色反应时火焰为绿色 |
根据上述信息填空:
(1)元素Y在元素周期表中的位置是。XY2由固态变为气态所需克服的微粒间作用力是。
(2)化合物甲是一种强氧化剂,由元素Y和Z组成,写出甲的化学式:,
(3)化合物乙由元素W和X组成,乙是同时含极性共价键和非极性共价键的相对分子质量最小的分子。在25℃、101kpa下,已知2g的气体乙在Y2气体中完全燃烧后恢复至原状态,放热QkJ,该燃烧反应的热化学方程式是。
(4)化合物丙仅由W、X、Y、Z、T中的四种元素组成,四种元素的质量比为1:6:40:64,化合物丙中含有两种阴离子,写出燃烧丙的化学方程式。
I.已知有机物A仅含碳、氢、氧3种元素,质谱分析可知其相对分子质量为46,核磁共 振氢谱显示分子中有三种不同化学环境的氢原子,且有如下的转化关系: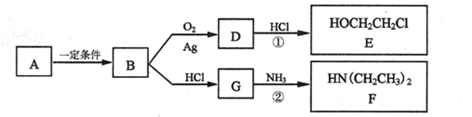
(1)由A→B的反应类型是________
(2)D的红外光谱表明分子内除C一H键、C一C键外还含有两个C一O单键,反应①中 D与HCl按物质的量之比1:1反应,则D的结构简式是 ______
II 化合物E和F是药品普鲁卡因合成的重要原料,普鲁卡因的合成路线如下(已知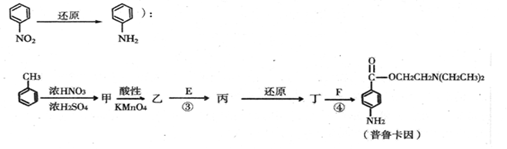
(3)丁的结构简式为_______________
(4)反应③的化学方程式是__________________
(5)普鲁卡因有两种水解产物戊和己,且戊与甲具有相同的分子式。符合下列条件的戊的同分异构体有______种(包含戊);
a.分子结构中含苯环,且每个苯环有2个侧链
b.分子结构中一定含官能团一NH2且一NH2直接与碳原子相连
(6)戊经聚合反应制成的高分子纤维广泛用于通讯、宇航等领域。该聚合反应的化学方 程式是__________________
A、B、C、D、E、F为前四周期元素且原子序数依次增大,其中A含有3个能级,且每个能 级所含的电子数相同;C的最外层有6个运动状态不同的电子;D是短周期元素中电负性最 小的元素;E的最高价氧化物的水化物酸性最强;F除最外层原子轨道处于半充满状态,其余 能层均充满电子。G元素与D元素同主族,且相差3个周期。
(1)元素A、B、C的第一电离能由小到大的是_______用元素符号表示)。
(2)E的最高价含氧酸中E的杂化方式为_______。
(3)F原子的外围电子排布式为_______,F的晶体中原子的堆积方式是下图中的_______(填写“甲”、“乙”或“丙”)。
(4)DE,GE两种晶体,都属于离子晶体,但配位数不同,其原因是_______
(5)已知DE晶体的晶胞如下图所示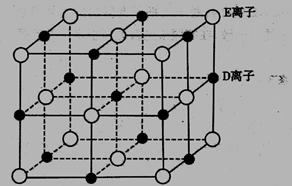
若将DE晶胞中的所有E离子去掉,并将D离子全部换为A原子,再在其中的4个“小 立方体”中心各放置一个A原子,且这4个“小立方体”不相邻。位于“小立方体”中的A原 子与最近的4个A原子以单键相连,由此表示A的一种晶体的晶胞(已知A — A键的键长 为a cm, NA表示阿伏加德罗常数),则该晶胞中含有_____个A原子,该晶体的密度是_____ g/cm
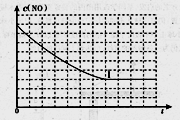
目前,消除氮氧化物污染有多种方法。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
③H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1
写出CH4 (g)与NO2 (g)反应生成N2 (g) ,CO2(g)和H2O(l)的热化学方程 式_____________________
(2)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g) N2(g)+CO2(g)某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T。C)条件下反应,反应进行到不同时间测得各物质的浓度如下
N2(g)+CO2(g)某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T。C)条件下反应,反应进行到不同时间测得各物质的浓度如下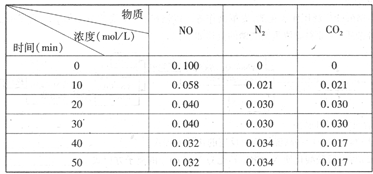
①不能作为判断反应达到化学平衡状态的依据是_______
A.容器内CO2的浓度保持不变
B.v正(N2)="2" v正(NO)
C.容器内压强保持不变
D.混合气体的密度保持不变
E.混合气体的平均相对分子质量保持不变
②在T。C时.该反应的平衡常数为_______(保留两位小数);
③在30 min,改变某一条件,反应重新达到平衡,则改变的条件是_______
(3)科学家正在研究利用催化技术将超音速飞机尾气中的NO和CO转变成CO2和N2,其反应为:
2CO+2NO N2+2CO2ΔH<0研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.为了分别验证温度、催化剂的比表面积对化学反 应速率的影响规律、某同学设计了三组实验,部分实验条件已经填在下表中。
N2+2CO2ΔH<0研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.为了分别验证温度、催化剂的比表面积对化学反 应速率的影响规律、某同学设计了三组实验,部分实验条件已经填在下表中。
①上表中:a=_______,b=________,e=________
②请在给出的坐标图中,画出上表中实验II和实验III条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明相应的实验编号