如图为刻蚀在玻璃上的精美的花纹图案,则该刻蚀过程中发生的主要化学反应为( )
| A.CaCO3+2HCl=CaCl2+H2O+CO2↑ |
| B.NaHCO3+HCl=NaCl+H2O+CO2↑ |
| C.Si+4HF=SiF4↑+2H2↑ |
| D.SiO2+4HF=SiF4↑+2H2O |
有科学家认为,随着文明的发展和社会的进步,人类有可能合成出或者从其他星球上发现
原子序数较大的元素,若发现或研制出第175号元素。试根据元素周期表知识推测,这种元素可能存在的位置是(已知:①第n周期最多容纳的元素种数为 或
或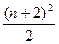 ,n=1,2,3……;②各周期中元素的种类数都是偶数)( )
,n=1,2,3……;②各周期中元素的种类数都是偶数)( )
| A.ⅡB族 | B.第八周期 | C.第九周期 | D.ⅥA族 |
某基态原子的第六电子层只有2个电子,则该原子的第五层中电子数为( )
| A.8个 | B.8个或18个 | C.8—18个 | D.18—32个 |
在26Fe原子核外的3d和4s轨道内,下列电子排布中正确的是( )
A. 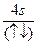 |
B.(↑)(↑↓)(↑)(↑)(↑) (↑↓) |
| C.(↑↑)(↑)(↑)(↑)(↑) (↑↑) | D.(↓)(↓)(↓)(↓↑)(↓) (↑↓) |
用NA代表阿伏加德罗常数的值,下列说法正确的是()
| A.在含有NA个CH3COO-的醋酸溶液中,H+数目略大于NA |
B.N60结构如下图,28 g N60单质中含有的N-N键个数为NA |
| C.2.9 g熟石膏(2CaSO4·H2O)含有的结晶水的分子数为0.02NA |
| D.在标准状况下,2.24 L的CCl4中含有C-Cl键的数目为0.4NA |
关于苯分子结构的研究经历了很长时间,著名科学家凯库勒最先提出了凯库勒结构式,并较好地解释了苯的一些性质。但随着理论研究的不断深入,杂化轨道理论可以更好地来解释苯分子的结构和性质。以下有关苯分子结构的说法,错误的是( )
| A.苯分子中每个碳原子的原子轨道都发生sp2杂化,形成夹角为120°的三个sp2杂化轨道 |
| B.每个碳原子的一个sp2杂化轨道采用“肩并肩”的方式重叠,形成一个大Π键 |
| C.苯分子中存在6个C—C σ键和6个C—H σ键 |
| D.乙烷、乙烯、乙炔分子中,碳原子轨道杂化方式和苯相同的只有乙烯 |