某溶液中含三种离子,加入过量氨水有沉淀生成,过滤后滤液中加过量盐酸,又有沉淀生成,再过滤,滤液中加入过量Na2CO3溶液,仍有沉淀生成,原溶液中含有的离子可能是
| A.Ag+、Fe2+、Ca2+ | B.Ag+、Mg2+、Ba2+ |
| C.Ca2+、Fe2+、Ba2+ | D.Al3+、Mg2+、Ba2+ |
下列图示与对应的叙述相符的是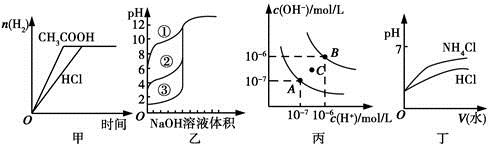
| A.图甲中曲线表示向等体积、等物质的量浓度的盐酸和醋酸溶液中,分别加入足量镁粉,产生H2的物质的量的变化 |
| B.图乙表示用0.1000 mol/L NaOH溶液分别滴定浓度相同的三种一元酸,由曲线可确定③的酸性最强 |
| C.图丙为水的电离平衡曲线图,若从A点到C点,可采用在水中加入适量NaOH固体的方法 |
| D.图丁表示将pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数时,二者pH的变化 |
化学是以实验为基础的学科,下列有关实验的描述正确的是
| A.向两支分别装有碳酸钠和碳酸氢钠固体的试管中各加几滴水,前者温度降低,后者温度升高 |
| B.向100 mL容量瓶中加入4.0 g NaOH固体,然后加水到刻度线,配制1.0 mol/L的NaOH溶液 |
| C.向酸性重铬酸钾溶液中加NaOH,溶液颜色由橙色慢慢变为黄色 |
| D.如图所示,随着空气的通入,试管内液面会慢慢上升至充满整支试管,而后液面又下降 |
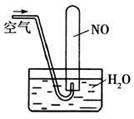
下列离子方程式书写正确的是
| A.硫酸铝溶液中滴加过量浓氨水:Al3++4NH3·H2O===AlO2-+4NH4+ +2H2O |
| B.乙酸钠溶液显碱性的原因:CH3COO-+H2O===CH3COOH+OH- |
| C.氢氧化钠溶液吸收少量SO2气体:SO2+2OH-===SO32- +H2O |
| D.漂白粉放置在空气中变质:ClO-+CO2+H2O===HClO+HCO3- |
1.52 g铜镁合金完全溶解于50 mL密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120 mL(标准状况)。向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是
| A.该合金中铜与镁的物质的量之比是21 |
| B.该浓硝酸中HNO3的物质的量浓度是14.0 mol/L |
| C.得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL |
| D.NO2和N2O4的混合气体中,NO2的体积分数是80% |
原子序数依次增大的短周期主族元素W、X、Y、Z和M中,W的最外层电子数为其周期数的二倍;X和Z的A2B型氢化物均为V形分子,Y的+1价离子比M的-1价离子少8个电子,根据以上叙述,下列说法中正确的是
| A.上述五种元素的原子半径大小为W<X<Y<Z<M |
| B.由这些元素形成的三原子分子中,空间结构为直线形的有WX2、WZ2、ZX2 |
| C.元素W与氢形成的原子个数比为11的化合物有很多种 |
| D.X与Y可形成含有非极性共价键的共价化合物 |