由石英制取硅胶,经历以下三步,试写出每步反应的化学方程式(是离子反应的,写出离子方程式)。
(1)用NaOH(aq)溶解石英:_______________________________。
(2)过滤,向滤液中加入盐酸,至沉淀不再产生:____________。
(3)微热,浓缩硅酸溶液;加热蒸干溶液,并使固体完全分解:_____________________;写出硅胶的一种用途:________________________________。
(14分)有机物甲可作为无铅汽油的抗爆震剂,其相对分子质量为Mr(甲),80<Mr(甲)<100。取0.3 mol甲在足量氧气中完全燃烧后,生成1.5 molCO2和1.8 molH2O。
(1)Mr(甲)=,甲的分子式为;
(2)甲的核磁共振氢谱有两个峰,峰面积之比为3∶1,则甲的结构简式为。
(3)烯烃丙与水加成可生成乙,乙为甲的同分异构体,红外光谱显示乙中有-OH和对称的-CH2-、-CH3等。
①丙的名称。
②乙的键线式为,乙所含官能团的名称为。
③乙同类别的同分异构体中,含有3个-CH3的结构有种。
④丙生成高聚物的反应方程式为。
(4)已知烯烃通过臭氧氧化并经锌和水处理得到醛或酮。例如: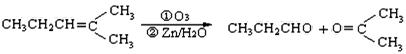
上述反应可用来推断烃分子中碳碳双键的位置。
某烃A的分子式为C6H10,经过上述转化生成 ,则烃A的结构可表示为。
,则烃A的结构可表示为。
(9分)芒硝化学式Na2SO4·10H2O,无色晶体,易溶于水,是一种分布很广泛的硫酸盐矿物。该小组同学设想,如果模拟工业上离子交换膜法制烧碱的方法,用如图所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠,无论从节省能源还是提高原料的利用率而言都更加符合绿色化学理念。
①该电解槽的阳极反应式为。此时通过阴离子交换膜的离子数(填“大于”或“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钠溶液从出口(填写“A”、“B”、“C”、“D”)导出。
③通电开始后,阴极附近溶液pH会增大,请简述原因。
④若将制得的氢气、氧气和氢氧化钠溶液组合为氢氧燃料电池,则电池负极的电极反应式为。已知H2的燃烧热为285.8 kJ/mol,则该燃料电池工作产生36 g H2O时,理论上有kJ的能量转化为电能。
(7分)醋酸是日常生活中最常见的调味剂和重要的化工原料,醋酸钠是其常见的盐。
(1)醋酸钠溶液中各离子浓度由大到小的顺序为。
(2)对于醋酸溶液和醋酸钠溶液的下列说法正确的是(填字母,下同)。
| A.稀释醋酸溶液,醋酸的电离程度增大,而稀释醋酸钠溶液则醋酸钠的水解程度减小 |
| B.升高温度可以促进醋酸电离,而升高温度会抑制醋酸钠水解 |
| C.醋酸和醋酸钠的混合液中,醋酸抑制醋酸钠的水解、醋酸钠也抑制醋酸的电离 |
| D.醋酸和醋酸钠的混合液中,醋酸促进醋酸钠的水解、醋酸钠也促进醋酸的电离 |
(3)物质的量浓度均为 0.1 mol/L 的 CH3COONa 溶液和 CH3COOH 溶液等体积混合(混合前后溶液体积变化忽略不计),混合液中的下列关系式正确的是。
(12分)同分异构现象是有机物种类繁多的原因之一,请按要求答题。
(1)C8H10含一个苯环的同分异构体有种,写出其中苯环上的氢被溴取代,所得一溴代物有三种的所有C8H10的名称。
(2)C9H12含一个苯环的同分异构体有种,写出苯环上有3个取代基的所有同分异构体的结构简式。
(3)C10H14含一个苯环的同分异构体有种,写出苯环上只有1个取代基的所有同分异构体的结构简式。
工业上从海水制取溴时,是以氯气氧化海水中的Br-,然后用空气将溴吹出,以碳酸钠溶液吸收。再用硫酸酸化得到单质溴。
(1)写出各步反应的化学方程式。
(2)把滤纸用淀粉和碘化钾的溶液浸泡,晾干后即得淀粉碘化钾试纸。将试纸润湿后,放在盛有溴气的集气瓶口,观察到的现象是,原因是(用化学方程式和必要的文字说明)。