写出以SiO2为原料制备H2SiO3的化学方程式_________________________________。
下表是元素周期表的一部分, 针对表中的①~⑩种元素,填写下列空白:
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0族 |
| 2 |
① |
② |
③ |
|||||
| 3 |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|||
| 4 |
⑨ |
⑩ |
(1)在这些元素中,化学性质最稳定的是(填元素符号)。最活泼的金属是(填元素符号),离子结构示意图为_________。元素⑩名称为,在周期表中的位置是。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是_______。
(3)这些元素中能形成两性氢氧化物的元素是(填名称),写出该元素的氢氧化物与④的最高价氧化物的水化物反应的离子方程式。
(4)元素①、②的最简单氢化物的稳定性:大于。(填写氢化物的分子式)
(5)请设计一个实验方案,比较⑥、⑦单质氧化性的强弱:。
A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A是周期表中原子半径最小的元素;B的最高价氧化物的水化物与其氢化物能相互反应生成盐;A与C可形成两种液态化合物,其分子中电子总数分别为10和18;D元素的主族序数等于其周期数;E原子的最外层电子数是其电子层数的2倍。
(1)E元素在周期表中的位置是。
(2)A与C形成的18电子物质中所含的化学键类型是。
A.离子键B.极性共价键C.非极性共价键
(3)写出A和E形成的化合物在水中的电离方程式。
(4)实验室制备D的最高价氧化物的水化物的离子方程式为。
(5)B元素与C元素形成的化合物中,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的B的含氧酸盐的化学式是__________。
根据A—J在周期表中的位置,用元素符号或化学式回答下列问题: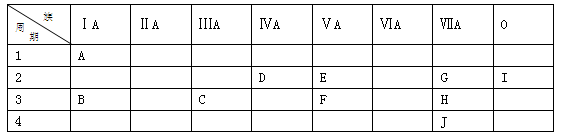
(1)J的原子结构示意图为。
(2)表中元素,化学性质最不活泼的是,只有负价而无正价的是,氧化性最
强的单质是,还原性最强的单质是。
(3)最高价氧化物的水化物碱性最强的是,酸性最强的是,呈两性的是。
(4)A分别与D、E、F形成的化合物中,最稳定的是。
(5)在C、D、G、H中,原子半径最大的是。
A、B、C、D、E、F六种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B与C为同一周期,D与F为同一周期,A与D、C与F分别为同一主族,C元素的原子最外层电子数是次外层电子数的三倍,D是所在周期原子半径最大的元素。又知六种元素所形成的常见单质在常温压下有三种是气体,三种是固体。
请回答下列问题:
(1)工业上用A和B的单质化合制备化合物X,该反应的化学方程式。
(2)若E是非金属元素,其单质在电子工业中有重要应用,请写出其氧化物溶于强碱溶液的离子方程式:。
(3)若D、E、F的最高价氧化物的水化物两两能发生反应,则E的最高价氧化物的水化物与D的最高价氧化物的水化物反应的离子方程式。
(4)用电子式表示化合物D2F的形成过程。
(5)由A、B、C三种元素组成的化合物X中共含有9个原子,X中所含化学键类型有。
(10)按要求填空
(1)二氧化硫气体通入碘水,碘水褪色,该反应的化学方程式。
(2)实验室制备氨气的化学方程式。
(3)制备漂白粉的化学方程式。
(4)收集满一烧瓶纯的二氧化氮气体做喷泉实验,假设溶液不扩散,所得溶液的物质的量浓度。
(5)金属锌和硝酸物质的量之比为2:5恰好完全反应,该反应的化学方程式。