能够快速、微量、精确的测定相对分子质量的物理方法是()
| A.质谱 | B.红外光谱 | C.紫外光谱 | D.核磁共振谱 |
A、B两种烃,它们含碳质量分数相同,下列关于A和B的叙述正确的是()
A.A和B一定是同分异构体 B.A和B不可能是同系物
C.A和B最简式一定相同 D.A和B的化学性质相似
实验室进行下列实验时,温度计水银球置于反应物液面以下的是()
| A.乙醇和浓硫酸混合加热,制乙烯 | B.从石油中提炼汽油 |
| C.用蒸馏方法提纯水 | D.实验室制取硝基苯 |
下列有机物命名正确的是()
A.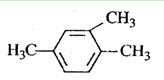 1,3,4-三甲苯 1,3,4-三甲苯 |
B.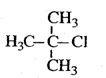 2-甲基-2-氯丙烷 2-甲基-2-氯丙烷 |
C.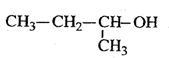 2-甲基-1-丙醇 2-甲基-1-丙醇 |
D.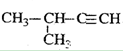 2-甲基-3-丁炔 2-甲基-3-丁炔 |
下列化合物的分子中,所有原子都处于同一平面的有 ()
| A.氟苯 | B.甲苯 | C.乙烷 | D.聚四氯乙烯 |