下列反应中,属于取代反应的是
①CH3CH=CH2+Br2 CH3CHBrCH2Br
CH3CHBrCH2Br
②CH3CH2OH CH2=CH2 ↑+H2O
CH2=CH2 ↑+H2O
③CH3COOH + CH3CH2OH  CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
④C6H6+Br2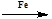 C6H5Br+H2O
C6H5Br+H2O
| A.①② | B.③④ | C.①③ | D.②④ |
将等质量的铜片在酒精灯上加热后,分别插入溶液中,放置片刻铜片质量减小的是
| A.水 | B.无水乙醇 | C.石灰水 | D.盐酸 |
鲨鱼是世界上唯一不患癌症的动物,科学研究表明,鲨鱼体内含有一种角鲨烯,具有抗癌性.已知角鲨烯分子中含有30个碳原子及6个C=C且不含环状结构,则其分子式为
| A.C30H60 | B.C30H56 | C.C30H52 | D.C30H50 |
为实现2008北京“科技奥运”战略,我国兴奋剂检测生物芯片装置已定型和批量生产,可快捷检测常见的16种兴奋剂。已知某兴奋剂乙基雌烯醇(etylestrenol)的结构如图所示。下列叙述中正确的是
| A.该物质可以视为烃类 | B.该有机物的分子式为C20H32O |
| C.不能使溴的四氯化碳溶液褪色 | D.该物质分子中的所有碳原子均共面 |
描述 CH3-CH=CH-C≡C-CF3分子结构的下列叙述中,正确的是
| A.6个碳原子有可能都在一条直线上 | B.6个碳原子不可能都在一条直线上 |
| C.6个碳原子不可能都在同一平面上 | D.所有原子有可能都在同一平面上 |