利用储能介质储存太阳能的原理是:白天在太阳光照射下某种固体盐熔化(实为盐溶于自身的结晶水)吸收能量,晚间熔盐释放出相应能量,从而使室温得以调节,已知几种盐的熔点及熔化时能量改变值如表所示:
| 盐 |
熔点/℃ |
质量与相对分子质量相等的盐熔化时吸热/kJ |
| CaCl2·6H2O |
29.0 |
37.3 |
| Na2SO4·10H2O |
32.4 |
77.0 |
| Na2HPO4·2H2O |
36.1 |
100.1 |
| Na2S2O3·5H2O |
48.5 |
49.7 |
下列说法正确的是( )
A.应选用CaCl2·6H2O
B.可选用Na2SO4·10H2O和Na2HPO4·12H2O
C.最好选用Na2SO4·10H2O,它更经济
D.以上皆不宜选用
全球已经批量生产的混合动力汽车采用镍氢动力电池。常见的镍氢电池某极是储氢合金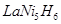 (在反应前后La、Ni的化合价为0),其电池的反应通常表示为:
(在反应前后La、Ni的化合价为0),其电池的反应通常表示为:
LaNi5H6+6NiOOH LaNi5+6Ni(OH)2
LaNi5+6Ni(OH)2
下列有关说法正确的是
| A.放电时电子流入储氢合金电极 |
B.放电时1mol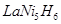 失去6mol电子 失去6mol电子 |
| C.放电时正极反应为NiOOH +H2O-e-= Ni(OH)2+OH- |
| D.充电时外接电源的正极应该接在储氢合金的电极上 |
在容积不变的密闭容器中存在如下反应2SO2(g)+O2(g)  2SO3(g) ΔH<0,某研究小组研究了其他条件下不变时,改变某一条件对上述反应的影响,下列分析正确的是( )
2SO3(g) ΔH<0,某研究小组研究了其他条件下不变时,改变某一条件对上述反应的影响,下列分析正确的是( )
| A.图Ⅰ表示的是t1时刻增大O2的浓度对反应速率的影响 |
| B.图Ⅱ表示的是t1时刻加入催化剂后对反应速率的影响 |
| C.图Ⅲ表示的是催化剂对平衡的影响,且甲的催化效率比乙的高 |
| D.图Ⅲ表示的是压强对化学平衡的影响,且乙的压强较高 |
某溶液中含有HCO3-、SO32-、SO42-、Cl-和Na+,若向其中通入Cl2,溶液中离子浓度增大的是
| A.HCO3- | B.SO42- | C.SO32- | D.OH- |
已知NO2遇水发生反应:2NO2 + H2O → HNO2 + HNO3。实验证明将NO2通入水中会逸出NO气体,而通入NaOH溶液中则可完全被吸收,通入Na2CO3溶液中只逸出CO2。下列说法错误的是
| A.HNO2非常不稳定,其分解产物为NO和H2O |
| B.NO2与水的反应机理:NO2先与水发生岐化反应生成HNO2和HNO3,HNO2再分解 |
| C.HNO2的酸性弱于碳酸的酸性 |
| D.NO2通入NaOH溶液中,生成的HNO2和HNO3都与NaOH发生中和反应 |
含MgCl2、AlCl3均为n mol的混合溶液,向其中滴NaOH溶液至过量。加入NaOH的物质的量与生成沉淀的物质的量的关系正确的是(离子(或物质)沉淀pH见右表)
| 离子 |
Mg2+ |
Al 3+ |
物质 |
Al(OH)3 |
| 开始沉淀pH |
8.93 |
3.56 |
开始溶解pH |
8.04 |
| 完全沉淀pH |
10.92 |
4.89 |
完全溶解pH |
12.04 |
