某高分子化合物含有如下结构片段对此结构的分析正确的是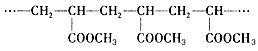
| A.它是加聚反应的产物 |
| B.合成它的小分子是CH3OH |
| C.合成它的小分子是CH2=CH2和HCOOCH3 |
| D.合成它的小分子是CH2=CHCOOCH3 |
X、Y、Z、W、M、N六种元素均位于元素周期表的前四周期(如下图所示)。有关这六种元素的下列叙述中不正确的是
| A.元素的简单离子半径M<W<Z | B.Y元素在自然界存在多种同素异形体 |
| C.最高价氧化物的水化物酸性W>N | D.N与Z的质子数之差为16 |
部分短周期元素的原子半径及主要化合价如下表,根据表中信息,判断以下叙述正确的是
| 元素代号 |
L |
M |
Q |
R |
T |
| 原子半径/nm |
0.166 |
0.143 |
0.112 |
0.104 |
0.066 |
| 主要化合价 |
+2 |
+3 |
+2 |
+6、-2 |
-2 |
A.氢化物的稳定性为H2T<H2R B.单质与稀盐酸反应的速率为L<Q
C.M与T形成的化合物具有两性 D.L2+与R2-的核外电子数相等
元素的原子结构决定其性质和在周期表中的位置。下列说法正确的是
| A.元素原子的最外层电子数等于元素的最高化合价 |
| B.多电子原子中,在离核较近的区域内运动的电子能量较高 |
| C.P、S、Cl得电子能力和最高价氧化物对应的水化物的酸性均依次增强 |
| D.元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 |
科学家曾发表论文,宣布发现了铝的“超级原子”结构——Al13和Al14。已知这类“超级原子”的最外层电子数之和为40时处于相对稳定状态。下列说法正确的是
| A.Al13和Al14互为同位素 |
| B.Al13中铝原子间通过离子键结合 |
| C.Al14最外层电子数之和为42,与第ⅡA族元素的性质相似 |
| D.Al13和Al14都具有较强的还原性,容易失去电子生成阳离子 |
下列关于指定粒子构成的叙述中,不正确的是
| A.37Cl与39K具有相同的中子数 |
B.第114号元素的一种核素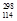 X与 X与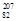 Pb具有相同的最外层电子数 Pb具有相同的最外层电子数 |
| C.H3O+与OH-具有相同的质子数和电子数 |
D.O 与S2-具有相同的质子数和电子数 与S2-具有相同的质子数和电子数 |