下列有关说法正确的是
| A.在轮船表面涂刷富锌油漆,能有效防止船体在海水中被腐蚀 |
B.0.1 mol·L-1氨水加水稀释后,溶液中 的值减小 的值减小 |
| C.用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大 |
| D.反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H<0 |
已知
H2(g)+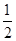 O2(g)===H2O(g) ΔH=a kJ·mol-1
O2(g)===H2O(g) ΔH=a kJ·mol-1
H2(g)+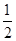 O2(g)===H2O(l)ΔH=b kJ·mol-1
O2(g)===H2O(l)ΔH=b kJ·mol-1
C(s)+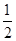 O2(g)===CO(g)ΔH=c kJ·mol-1
O2(g)===CO(g)ΔH=c kJ·mol-1
C(s)+H2O(g) = CO(g) +H2(g)ΔH=d kJ·mol-1
下列关于上述反应焓变的判断正确的是
| A.a>0,c<0 | B.b<0,d<0 |
| C.a>b | D.d=c-b |
短周期主族元素W、X、Y、Z的位置关系如图。下列说法一定正确的是
| X |
||
| W |
Y |
Z |
A.元素Y位于元素周期表的第3周期ⅥA族
B.原子半径的大小顺序为:rW>rY>rZ
C.元素Y的最高价氧化物对应水化物的酸性比Z的强
D.元素W的气态简单氢化物的热稳定性比X的强
下列各组物质中,不能按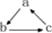 关系相互转化的是(“→”表示一步完成)
关系相互转化的是(“→”表示一步完成)
| 选项 |
A |
B |
C |
D |
| a |
SiO2 |
NaOH |
HNO3 |
Cu |
| b |
Na 2SiO3 |
Na2CO3 |
NO |
CuSO4 |
| c |
H2SiO3 |
NaHCO3 |
NO2 |
Cu(OH)2 |
下列电离或离子方程式正确的是
| A.碳酸的电离方程为:H2CO3⇌2H++CO32- |
| B.NaHS水解方程式为:HS-+H2O⇌H3O++S2- |
| C.用醋酸除去水垢中的氢氧化镁:Mg(OH)2+2CH3COOH=Mg 2+++2CH3COO-+2H2O |
| D.将少量SO2气体通入氨水中:SO2 + NH3·H2O=NH4++ HSO3- |