核磁共振(NMR)技术已广泛应用于复杂分子结构和医学诊断等高科技领域。已知只有质子数或中子数为奇数的原子核有NMR现象,试判断下列原子均可产生NMR现象的一组是( )
| A.O、P、1831119Sn |
| B.27Al、19F、12C |
| C.元素周期表中ⅤA族所有元素的原子 |
| D.元素周期表中第1周期所有元素的原子 |
根据金属活动性顺序表,Cu不能发生:Cu+2H2O=Cu(OH)2+H2↑的反应.但选择恰当电极材料和电解液进行电解,这个反应就能变为现实.下列四组电极和电解液中,能实现该反应最为恰当的是
| 阳极 |
阴极 |
电解液 |
|
| A. |
石墨棒 |
石墨棒 |
CuSO4溶液 |
| B. |
Cu |
石墨棒 |
Na2SO4溶液 |
| C. |
Cu |
Fe |
H2SO4溶液 |
| D. |
Cu |
Pt |
H2O |
在密闭容器中一定量混合气体发生反应:2A (g) + B (g))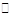 xC(g),达到平衡时测得 A的浓度为 0.5 mol/L,在温度不变的条件下,将容器的容积扩大到原来的2倍, 再达平衡时测得A的浓度为 0.3 mol/L ,下列有关判断正确的是
xC(g),达到平衡时测得 A的浓度为 0.5 mol/L,在温度不变的条件下,将容器的容积扩大到原来的2倍, 再达平衡时测得A的浓度为 0.3 mol/L ,下列有关判断正确的是
| A.x = 3 | B.平衡向正反应方向移动 |
| C.B的转化率降低 | D.C的体积分数增大 |
关于如图所示装置的叙述,正确的是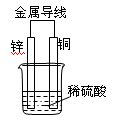
| A.铜是负极,铜片上有气泡产生 | B.铜片质量逐渐减少 |
| C.电流从锌片经导线流向铜片 | D.氢离子在铜片表面被还原 |
在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
| 物质 |
X |
Y |
Z |
| 初始浓度(mol·L-1) |
0.1 |
0.2 |
0 |
| 平衡浓度(mol·L-1) |
0.05 |
0.05 |
0.1 |
下列说法错误的是
A.反应达平衡时,X的转化率为50%
B.反应可表示为:X+3Y 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.当混合气体的平均相对分子质量不变时,该反应达到了化学平衡状态
在2A+B  3C+5D反应中,表示该反应速率最快的是
3C+5D反应中,表示该反应速率最快的是
A.υ(A)= 0.5 mol/(L·s) B.υ(B)= 0.3 mol/(L·s)
C.υ(C)= 0.8 mol/(L·s) D.υ(D)= 1 mol/(L·s)