下列反应的离子方程式正确的是
A.在碳酸氢钙溶液中加入过量氢氧化钠溶液:
B.在10mL0.1mol·L-1的FeBr2溶液中滴入少量氯水(0.09mol·L-1)
2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
C.硫酸亚铁溶液中通入H2S气体
Fe2++H2S=FeS↓+2H+</PGN0020A.TXT/PGN>
D.碱式碳酸铜溶于稀硫酸
Cu2(OH)2CO3+4H+=2Cu2++CO2↑+3H2O
PM 2.5是指大气中直径小于或等于2.5微米的颗粒物,也称为可入肺颗粒物。2012年2月,国务院同意发布新修订的《环境空气质量标准》增加了PM 2.5监测指标。下列情况不会增加空气中PM 2.5的是
| A.露天焚烧秸秆 | B.直接用煤作燃料 |
| C.汽车排放尾气 | D.利用太阳能发电 |
2012年诺贝尔化学奖颁发给了生物化学领域的两位科学家:美国医学家罗伯特·J·尼科威和美国生物学家布莱恩·克比尔卡。对于两位科学家所做的研究,美国化学会主席巴萨姆·萨卡什里说:“这是向人类智慧的一次伟大致敬,它帮助我们了解在人类的身体中到底发生了什么复杂的过程。”下列选项属于2012诺贝尔化学奖获奖原因的是
| A.准晶体的发现 |
| B.G蛋白偶联受体研究 |
| C.对有机合成中钯催化偶联反应的研究 |
| D.发展了有机合成中的复分解法 |
“绿色化学”要求从经济、环保和技术上设计可行的化学反应。据此,由单质镁制硝酸镁的下列4个方案中,你认为可行而且符合“绿色化学”要求的方案是
A.Mg  Mg(NO3)2 Mg(NO3)2 |
B.Mg  MgCl2 MgCl2 Mg(OH)2 Mg(OH)2  Mg(NO3)2 Mg(NO3)2 |
C.Mg 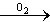 MgO MgO  Mg(NO3)2 Mg(NO3)2 |
D.Mg  MgSO4 MgSO4 Mg(NO3)2 Mg(NO3)2 |
下列元素①Cl、②Na、③Br、④I、⑤Mg、⑥U属于海水中的微量元素的是
| A.①②⑤ | B.④⑥ | C.①②③④ | D.③④⑤⑥ |
不能鉴别二氧化碳与二氧化硫的试剂是
| A.品红溶液 | B.澄清的石灰水 | C.溴水 | D.酸性高锰酸钾溶液 |