已知元素X的原子序数小于元素Y的原子序数,X、Y间形成的常见化合物的分子式可表示为X2Y、X2Y2。则这两种元素的原子序数之和等于
| A.16 |
| B.17 |
| C.18 |
| D.19 |
在①丙烯②氯乙烯③苯④甲苯四种有机化合物中,分子内所有原子均在同一平面的是
| A.①② | B.②③ | C.③④ | D.②④ |
下列过程中所发生的化学反应属于取代反应的是
| A.光照射甲烷与氯气的混合气体 |
| B.乙烯通入溴水中 |
| C.在镍做催化剂的条件下,苯与氢气反应 |
| D.在铜或银做催化剂的条件下,乙醇与氧气反应 |
相同温度下体积固定的密闭容器中,发生如下可逆反应: A2(g) + 3B2(g) 2AB3(g),下列情况一定能说明该可逆反应已经达到化学平衡状态的是
2AB3(g),下列情况一定能说明该可逆反应已经达到化学平衡状态的是
①反应中各组分的物质的量不随时间而变化了②混合气体的总物质的量不随时间而变化了③容器内的压强不随时间而变化了⒁④容器内气体的平均相对分子质量不随时间而变化了⑤容器内气体的密度不随时间而变化了⑥V(A2) 正/v(B2) 正="1/3" ⑦V(A2) 正/v(B2) 逆="1/3" ⑧c(A2):c(B2):c(AB3)=1:3:2⑨ c(A2)=c(B2)=c(AB3)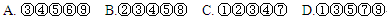
甲、乙两容器中都在进行A B +C的反应,甲中每分钟减少4 molA,乙中每分钟减少2 molA,则甲、乙两容器中的反应速率的比较是
B +C的反应,甲中每分钟减少4 molA,乙中每分钟减少2 molA,则甲、乙两容器中的反应速率的比较是
| A.甲更快 | B.无法确定 | C.相等 | D.乙更快 |
反应①1000K时,A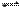 B +C;②500K时,D
B +C;②500K时,D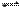 E +F,它们的反应速率的关系是
E +F,它们的反应速率的关系是
| A.①=② | B.①﹤② | C.①﹥② | D.无法确定 |