被称之为“软电池”的纸质电池,采用一个薄层纸片作为传导体,在其一边镀锌,而在其另一边镀二氧化锰。在纸内的离子“流过”水和氧化锌组成的电解液。电池总反应为Zn+2MnO2+H2O====ZnO+2MnO(OH)。下列说法正确的是( )
| A.该电池的正极为锌 |
| B.该电池反应中二氧化锰起催化剂作用 |
| C.当0.1 mol Zn 完全溶解时,流经电解液的电子个数为1.204×1023 |
| D.电池正极反应式为2MnO2+2e-+2H2O="===2MnO" (OH)+2OH- |
绿色化学对于化学反应提出了“原子经济性”(原子节约)的新概念及要求。理想的原子经济性反应是原料分子中的原子全部转变成所需产物,不产生副产物,实现零排放。下列几种生产乙苯的方法中,原子经济性最好的是(反应均在一定条件下进行)( )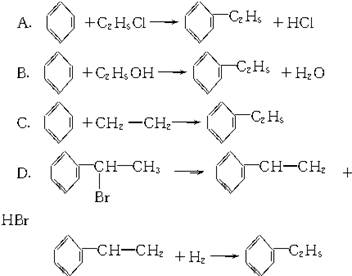
等质量的下列烃完全燃烧时所需氧气最多的是 …( )
| A.C6H6 | B.C2H6 | C.C2H4 | D.C4H6 |
下列说法中不正确的是( )
| A.分子组成满足CnH2n-6的化合物一定属于芳香烃 |
| B.甲苯与混酸作用一次可向苯环中引入三个—NO2,而苯只能引入一个—NO2,说明甲苯的化学活泼性比苯强 |
| C.二甲苯有三种同分异构体,它们被高锰酸钾酸性溶液氧化后都能生成二元芳香酸 |
| D.2,4,6三硝基甲苯,俗称TNT,是一种黄色烈性炸药 |
已知化合物B3N3H6(硼氮苯)与C6H6(苯)的分子结构相似,如下: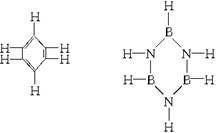
则硼氮苯的二氯取代物B3N3H4Cl2的同分异构体的数目为( )
| A.2种 | B.3种 | C.4种 | D.6种 |
苯甲酸钠是常用的食品防腐剂,其结构简式为 ,以下对苯甲酸钠描述错误的是( )
,以下对苯甲酸钠描述错误的是( )
| A.属于盐类 | B.能溶于水 |
| C.属于烃类 | D.不易分解 |