下列装置或操作能达到实验目的的是( )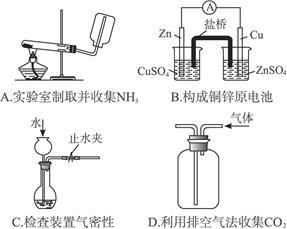
向盛有100 mL HCl溶液的烧杯中加入一定量的铝土矿(含Al2O3、Fe2O3、SiO2)样品,充分反应后过滤,向滤液中加入5 mol/L的NaOH溶液,产生沉淀的量与所加NaOH溶液的体积的关系如下图所示。则原HCl物质的量浓度是
| A.4mol/L | B.3mol/L |
| C.2mol/L | D.1mol/L |
人体正常血红蛋白中含有Fe2+,若误食亚硝酸盐,会导致Fe2+转化为Fe3+而中毒,服用维生素C可以解毒。对上述事实的分析正确的是
| A.亚硝酸盐是还原剂 |
| B.维生素C是氧化剂 |
| C.维生素C将Fe3+还原为Fe2+ |
| D.亚硝酸盐被氧化 |
过氧化氢在二氧化锰催化作用下分解放出氧气的反应机理如下:
①MnO2+H2O2+2H+===Mn2++O2↑+2H2O
②Mn2++H2O2===MnO2+2H+
下列说法正确的是
| A.H2O2在①中是氧化剂,在②中是还原剂 |
| B.Mn2+在①中是还原产物,在②中是氧化产物 |
| C.在①中每生成1 mol O2,转移的电子数为2.408×1024 |
| D.在二氧化锰催化作用下1 mol H2O2分解生成0.5 mol O2 |
如图装置可用于收集气体并验证其某些化学性质,下列相关的选项正确的是
| 选项 |
气体 |
试剂 |
现象 |
结论 |
| A |
NH3 |
酚酞试液 |
溶液变红色 |
NH3的水溶液显碱性 |
| B |
SO2 |
酸性KMnO4溶液 |
溶液褪色 |
SO2具有漂白性 |
| C |
HCl |
硅酸钠溶液 |
生成白色沉淀 |
Cl的非金属性比Si强 |
| D |
X |
KI淀粉溶液 |
溶液变蓝 |
X可能是Cl2 |
除去下列物质中所含的杂质(括号内为杂质),选用试剂正确的是
| A.Al2O3(SiO2):NaOH溶液 |
| B.CO2(SO2):Na2CO3溶液 |
| C.FeCl2溶液(FeCl3):Fe粉 |
| D.NaHCO3溶液(Na2CO3溶液):Ca(OH)2溶液 |