可用于分离或提纯物质的方法有:
①分馏 ②盐析 ③过滤 ④重结晶 ⑤升华 ⑥渗析 ⑦电解 ⑧加热分解 ⑨蒸馏
下列各组混合物的分离或提纯应选用上述哪种方法最合适?
| A.除去Ca(OH)2溶液中悬浮的CaCO3微粒 |
| B.除去Fe(OH)3胶体中混有的Cl- |
| C.除去乙醇中溶解的微量食盐 |
| D.分离石油中各种不同沸点范围的成分 |
E.除去固体碘中混有的少量碘化钠
F.除去氧化钙中的碳酸钙
用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定)。欲使溶液恢复到起始状态,可向溶液中加入( )
| A.0.15 mol CuO | B.0.1 mol CuCO3 |
| C.0.075mol Cu(OH)2 | D.0.05 mol Cu2(OH)2CO3 |
有一种锂电池,用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂溶解在亚硫酰氯(SOCl2)中形成,电池的总反应式为8Li+3SOCl2=6LiCl+Li2SO3+2S,则下列叙述正确的是 ( )
| A.用该电池电解CuCl2溶液产生2.24LCl2时,有0.2mol电子转移 |
| B.金属锂作电池的负极,石墨作电池的正极,加入硫酸可提高电解质的导电性 |
| C.电池工作(放电)过程中,SOCl2被还原为Li2SO3 |
| D.电池工作过程中,负极消耗的锂与正极生成的硫质量之比为7:8 |
反应mA(g)+ nB(g) 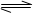 pC(g)+qD(g),经5min后达到平衡,测得此时A的浓度减少了a mol/L,同时C的浓度增加了2a/3 mol/L,又测得平均反应速率v(C)=2v(B)。达到平衡后,若保持温度不变,给体系加压,平衡不移动,那么该反应可表示为()
pC(g)+qD(g),经5min后达到平衡,测得此时A的浓度减少了a mol/L,同时C的浓度增加了2a/3 mol/L,又测得平均反应速率v(C)=2v(B)。达到平衡后,若保持温度不变,给体系加压,平衡不移动,那么该反应可表示为()
A.2A(g)+ 6B(g)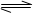 3C(g)+5D(g)B.3A(g)+ B(g)
3C(g)+5D(g)B.3A(g)+ B(g)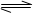 2C(g)+2D(g)
2C(g)+2D(g)
C.3A(g)+ B(g) 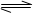 2C(g)+ D(g) D.A(g)+ 3B(g)
2C(g)+ D(g) D.A(g)+ 3B(g)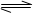 2C(g)+2D(g)
2C(g)+2D(g)
可逆反应
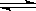
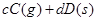
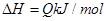 ,反应过程中,当其他条件不变时,C在混合物中的含量与温度(T)的关系如图I所示,反应速率(v)与压强(p)的关系如图II所示。据图分析,以下说法正确的是( )
,反应过程中,当其他条件不变时,C在混合物中的含量与温度(T)的关系如图I所示,反应速率(v)与压强(p)的关系如图II所示。据图分析,以下说法正确的是( )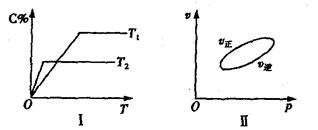
| A.T1<T2,Q>0 | B.增大压强,物质B的转化率增大 |
| C.反应达平衡后,增加少量的D,平衡逆向移动 | D.a+b>c+d |
实验室用标准盐酸测定未知浓度NaOH溶液,用甲基橙作指示剂,下列操作可能使测定结果偏低的是( )
| A.酸式滴定管在装酸液前未用标准酸液润洗 |
| B.开始时酸式滴定管尖嘴部分留有气泡,滴定过程中消失 |
| C.锥形瓶内溶液颜色由黄变橙时立即停止滴定 |
| D.盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次 |