要使含K+、Ba2+、Al3+、Fe3+、Ag+的硝酸盐混合溶液进行分离并制成各自阳离子的硝酸盐溶液,现设计如下分离过程。所加入的试剂可从以下选用,氨水、NaOH、K2CO3、KOH、NaHCO3、HNO3、CH2OH(CHOH)4CHO。
(1) 请将上述实验步骤中所选用的试剂分子式和各种固体与滤液的成分(离子符合或分子式)填写在下表中。
(2) 
(2)写出上述实验过程中步骤①~⑤的离子方程式。____。
实验小组为探究SO2的漂白性和还原性,设计了以下实验。
完成下列填空:
(1).实验室用亚硫酸钠粉末跟硫酸制取二氧化硫,有下列三种硫酸溶液,应选用 (选填编号),其理由是 。
a.98%浓硫酸 b.70%硫酸 c.10%稀硫酸
І.漂白性
(2).用如图所示装置(气密性良好)进行实验,观察到如下现象:ⅰ中红色褪去、
ⅱ中无变化。
①足量碱石灰的作用是 。
②从实验中可知使品红的水溶液褪色的 微粒可能是 。
(3).实验小组进一步实验如下:取等量相同浓度
的品红水溶液于两支试管中,再分别加入少量Na2SO3固体和NaHSO3固体,两支试管中的品红都褪色,于是得出结论:使品红褪色的微粒肯定是HSO3–或SO32–。你认为这一结论是否正确 ,理由是 。
ІІ.还原性
(4).将SO2通入FeCl3溶液中,使其充分反应。
①SO2与FeCl3反应的离子方程式是 ,如何检验该反应所得含氧酸根离子 。
②实验中观察到溶液由黄色变为红棕色,静置一段时间,变为浅绿色。
已知:红棕色为FeSO3(墨绿色难溶物)与FeCl3溶液形成的混合色;Fe3+可氧化SO32–。
则②中红棕色变为浅绿色的原因是 。
毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2.2H2O的流程如下:
(1)写出“浸取”环节发生的主要反应的离子方程式:____ 。实验室用37%的盐配置15%的盐酸,除量筒外还需使用下列仪器中的__________。
a.烧杯 b.容量瓶 c.滴定管 d.玻璃棒
(2)下图是一些难溶氢氧化物在不同pH下的沉淀一溶解图
①滤渣I中含 (填化学式)。再加入NaOH调节pH =12.5可除去_____________(填离子符号)。
②加入H2C204应避免过量的原因是_____________。
(3)25℃,H2C204和HF两种酸的电离平衡常数如下: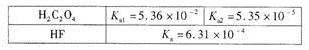
①HC2O4-的电离平衡常数表达式Ka2=________。
②H2C2O4溶液和NaF溶液反应的离子方程式为__________
FeSO4.7H2O俗称“绿矾”,是一种蓝绿色晶体。某课外活动小组同学在实验室发现一瓶绿矾已部分变质,拟用该试剂为原料,重新制取FeSO4.7H2O晶体,并测定其纯度。
【查阅资料】
①绿矾化学性质常不稳定,在潮湿空气中逐渐氧化变质,久置的绿矾溶液逐渐变为黄色,并出现棕黄色浑浊;
②硫酸亚铁的溶解度随温度升高而增大。
【制备晶体】
①取一定量已变质的“绿矾”于烧杯中,加适量水,搅拌,得到棕黄色悬浊液。
②加入一定量稀H2SO4和过量铁屑,在60℃左右水浴中加热,充分反应,待溶液完全变为浅绿色为止。
③趁热过滤,并用少量热水洗涤,将滤液转入到密闭容器中,静置、冷却结晶。
④待结晶完毕后,过滤出晶体,用少量冰水洗涤,再用滤纸吸干水分,最后放人广口瓶中密闭保存。
请回答下列问题:
(1)完成久置绿矾溶液在空气中变质反应的离子方程式:
(2)实验步骤②中加入稀硫酸的目的是_____________
(3)实验步骤③中趁热过滤目的是_____________
(4)实验中两次用到过滤操作,完成该操作的玻璃仪器有烧杯、 。
【测定纯度】
有同学认为,制备过程中可能有少量Fe2+被氧化为Fe3+,导致产品不纯。他们设计了如下方案测定产品的纯度。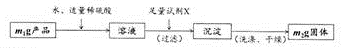
请回答下列问题:
限选试剂:NaOH溶液、KSCN溶液、H2O2溶液、苯酚稀溶液、K3[Fe(CN)6]溶液、BaCl2溶液
(5)检验产品中是否含有Fe3+的无机试剂最好是:_____________。
(6)试剂X是:_____________。
(7)产品中FeSO4.7H2O(摩尔质量为278 g/mol)的含量为:_____________(用质量分数表示)。
在呼吸面具和潜水艇中可用过氧化钠作为供氧剂。在实验室里按下图所示装置,可进行模拟实验证明Na2O2的供氧作用。
(1)A中发生反应的离子方程式是 。
(2)填写表中空格。
| 仪器 |
加入试剂 |
加入该试剂的目的 |
| B |
饱和NaHCO3溶液 |
|
| D |
(3)试管F中收集满气体后,验证该气体的实验操作方法是 。
(4)C中反应的化学方程式是 。
某研究性学习小组欲由硫铁矿烧渣(主要成分为Fe、Fe2O3、SiO2、Al2O3 )制备绿矾(FeSO4·7H2O),流程图如下:
(1)操作a的名称是 。
(2)加入足量试剂X后,发生反应的离子方程式为 、 。
(3)若向溶液2中滴加KSCN溶液,无明显现象。固体与足量稀硫酸发生反应的离子方程式是 、 、 。