两个容积相同的容器,一个盛有一氧化氮,另一个盛有氮气和氧气,在同温同压下两容器内的气体一定具有相同的( )
| A.原子总数 | B.质子总数 |
| C.电子总数 | D.质量 |
设NA为阿伏加德罗常数的值。下列说法正确的是
| A.1L1mol/L的NaClO溶液中含有ClO-的数目为NA |
| B.标准状况下,2.24LCH3COOH的分子数为0.1NA |
| C.1L0.1mol/L的氨水中有0.1NA个NA原子 |
| D.标准状况下,0.1molCl2溶于水,转移的电子数目为0.1 NA |
不能实现如下图转化的单质甲是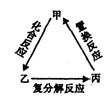
| A.Si | B.S | C.Fe | D.Cu |
若X+酸 盐+水,则X不可能属于
盐+水,则X不可能属于
| A.氧化物 | B.单质 | C.碱 | D.电解质 |
化学在生产和日常生活中有着重要的应用。下列说法正确的是
| A.汽车的排气管上装有“催化转换器”, 使有毒的CO和NO反应生成N2和CO2 |
| B.向煤中加入适量石灰石,使煤燃烧产生的SO2最终生成CaSO3,可减少对大气的污染 |
| C.大量燃烧化石燃料排放的废气中含CO2、SO2,从而使雨水的pH=5.6形成酸雨 |
| D.陶瓷、水泥和光导纤维均属于硅酸盐材料 |
HF气体分子间容易缔合.某HF气体由HF、(HF)2、(HF)3三者混合而成,其平均相对分子质量为42,则(HF)3的体积分数可能为()
| A.51% | B.56% | C.57% | D.10% |