
| A.氢的四种同位素 |
| B.化学性质不同的氢原子 |
| C.氢元素的四种不同微粒 |
| D.氢元素的四种核素 |
Na2FeO4是一种高效多功能水处理剂,应用前景十分看好。一种制备Na2FeO4的方法可用化学方程式表示如下:
2FeSO4 + 6Na2O2= 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑,对此反应下列说法中正确的是
| A.Na2O2只作氧化剂 |
| B.Na2FeO4既是氧化产物又是还原产物 |
| C.O2 是还原产物 |
| D.2 mol FeSO4发生反应时,反应中共有8 mol电子转移 |
下列关于碳酸钠和碳酸氢钠的比较中,正确的是
| A.相同温度下,在水中,碳酸氢钠的溶解度大于碳酸钠的溶解度 |
| B.将石灰水加入碳酸氢钠溶液中不产生沉淀,加入碳酸钠溶液中产生白色沉淀 |
| C.将100 mL 0.10 mol/L盐酸溶液分别逐滴滴入到10 mL 1.00 mol/L的碳酸钠溶液或10 mL 1.00 mol/L碳酸氢钠溶液中,两者都能放出二氧化碳气体,但碳酸氢钠与酸反应产生二氧化碳的剧烈程度明显强于碳酸钠 |
| D.在一定温度下,物质的量浓度相同时,碳酸氢钠溶液的碱性弱于碳酸钠溶液 |
某氯原子的质量为a g , C-12原子的质量为b g,用NA表示阿伏加德罗常数,下列说法中不正确的是
A.则该氯原子构成氯分子的相对分子质量为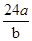 |
| B.1 mol该氯原子的质量为aNA g |
C.m g该氯原子的物质的量为 mol mol |
D.n g该氯原子所含的电子数为 |
下列离子方程式正确的是
| A.用FeCl3溶液腐蚀印刷电路板:Fe3++Cu=Fe2++Cu2+ |
B.惰性电极电解氯化钠溶液:2Cl- +2 H2O  Cl2 ↑+H2 ↑+2OH— Cl2 ↑+H2 ↑+2OH— |
| C.Ca(HCO3)2与过量Ca(OH)2溶液反应:Ca2++HCO3-+2OH-=CaCO3↓+CO32- +2H2O |
| D.向Fe(OH)3悬浊液中加入醋酸:Fe(OH)3+3H+=Fe3++3H2O |
根据
(1)Fe+Cu2+=Fe2++Cu (2)2Fe3++Cu=Cu2++2Fe2+
(3)2Fe2++Cl2=2Fe3++2Cl- (4)HClO+H++Cl-=H2O+Cl2,
可以判断出各粒子的氧化性由强到弱的顺序正确的是
| A.HClO>Cl2>Fe3+>Cu2+ | B.Cl2>HClO>Fe3+>Cu2+ |
| C.Cl2>Fe3+>HClO>Cu2+ | D.HClO>Cl2>Cu2+>Fe3+ |