下列叙述可用于说明H2+I2 2HI已达到平衡状态的是
2HI已达到平衡状态的是
| A.一个H-H键断裂的同时有一个I-I键组成 |
| B.一个H-H键断裂的同时有一个I-I键断裂 |
| C.一个H-I键形成的同时有一个H-H键断裂 |
| D.一个H-I键断裂的同时有一个H-H键形成 |
用隔膜电解法处理高浓度乙醛废水的原理是使乙醛分别在两极发生反应,转化为乙醇和乙酸。实验室中,以一定浓度的乙醛—Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置示意图如图所示。有关说法不正确的是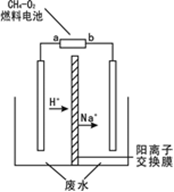
| A.图中燃料电池的a极应通入氧气 |
| B.乙醇在阴极产生 |
| C.电解过程中,阴极区有NaOH产生 |
| D.每生成1mol乙酸,理论上至少消耗标况下氧气22.4L |
一氯化碘(ICl)、三氯化碘(ICl3)是卤素互化物,它们的性质与卤素单质相似,如:2ICl+2Zn="==" ZnI2+ZnCl2。以下判断正确的是
| A.ICl3与水反应的产物为HI和HClO |
| B.ICl3与KI反应时,氯元素被还原 |
| C.ICl与冷NaOH溶液反应的离子方程式为:ICl+2OH—=IO—+Cl—+H2O |
| D.ICl与水的反应属于氧化还原反应 |
向恒温恒容密闭容器中加入1molHI,发生下列反应2HI(g) H2(g)+I2(g),△H >0。达到平衡后,往容器中再加入1molHI,有关说法正确的是
H2(g)+I2(g),△H >0。达到平衡后,往容器中再加入1molHI,有关说法正确的是
| A.平衡不移动,HI平衡转化率不变 |
| B.平衡向右移动,HI平衡转化率不变 |
| C.平衡向左移动,HI平衡转化率减小 |
| D.平衡向右移动,HI平衡转化率增大 |
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是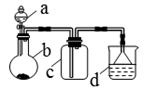
| 选项 |
a中物质 |
b中物质 |
c中收集气体 |
d中物质 |
| A |
浓氨水 |
CaO |
NH3 |
H2O |
| B |
浓NaOH |
铝屑 |
H2 |
H2O |
| C |
浓盐酸 |
MnO2 |
Cl2 |
NaOH溶液 |
| D |
浓硝酸 |
Cu |
NO2 |
NaOH溶液 |
用NA表示阿伏加德罗常数的值。下列叙述中正确的是
| A.56 g铁粉在22.4 L氯气中充分燃烧,转移的电子数为3NA |
| B.12gNaHSO4晶体中含有的阳离子数为0.2NA |
| C.44 g C3H8中含有的共用电子对数目为10NA |
| D.t ℃时,1 L pH=6.5的纯水中,含OH-的数目为10-7.5NA |