在2NO2 N2O4的可逆反应中,下列状态属平衡状态的是
N2O4的可逆反应中,下列状态属平衡状态的是
| A.混合物中,NO2的百分含量不再改变的状态 |
| B.NO2的分子数与N2O4分子数的比值为2∶1的状态 |
| C.体系的颜色不再发生变化的状态 |
| D.NO2全部转变成N2O4的状态 |
有—CH3,— OH,—COOH,—C6H5四种基团,两两结合而成的有机化合物中,水溶液有酸性的有
| A.3种 | B.4种 | C.5种 | D.6种 |
手性分子是指在分子结构 中,当a、b、x、y为彼此互不相同的原子或原子团时,称此分子为手性分子,中心碳原子为手性碳原子。下列分子中指定的碳原子(用*标记)不
中,当a、b、x、y为彼此互不相同的原子或原子团时,称此分子为手性分子,中心碳原子为手性碳原子。下列分子中指定的碳原子(用*标记)不 属于手性碳原子的是
属于手性碳原子的是
A.苹果酸 |
B.丙氨酸 |
C.葡萄糖 |
D.甘油醛 |
(CH3CH2)2CHCH3的正确命名是
| A.3-甲基戊烷 | B.2-甲基戊烷 | C.2-乙基丁烷 | D.3- 乙基丁烷 乙基丁烷 |
下列物质不能使酸性KMnO4溶液褪色的是
A.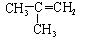 |
B.C2H2 | C. |
D.CH3COOH |
下列物质的所有原子不可能都在同一平面上的是
| A.氯乙烯 | B.苯乙烯 | C.苯酚 | D.苯甲醇 |