根据S2O82-+2e→2SO42-,Mn2++4H2O→MnO4-+8H++5e,推测氧化1.5molMn2+需要Na2A2O8的物质的量为
| A.1.5mol |
| B.3.75mol |
| C.3.25mol |
| D.3.125mol |
X、Y、Z三种气体,取X和Y按1∶1的物质的量之比混合,放入密闭容器中发生如下反应:X+2Y 2Z,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3∶2,则Y的转化率最接近于
2Z,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3∶2,则Y的转化率最接近于
| A.33% | B.40% | C.50% | D.65% |
在密闭容器中,反应X2(g)+Y2(g) 2XY(g) ΔH<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是
2XY(g) ΔH<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是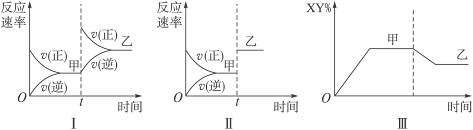
| A.图Ⅰ是加入适当催化剂的变化情况 |
| B.图Ⅱ是扩大容器体积的变化情况 |
| C.图Ⅲ是增大压强的变化情况 |
| D.图Ⅲ是升高温度的变化情况 |
一定条件下,在体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:
2X(g)+Y(g) Z(g),经60 s达到平衡,生成0.3 mol Z,下列说法正确的是
Z(g),经60 s达到平衡,生成0.3 mol Z,下列说法正确的是
| A.以X浓度变化表示的反应速率为0.001 mol·(L·s) -1 |
| B.将容器体积变为20 L,Z的平衡浓度变为原来的1/2 |
| C.若升高温度Y的转化率减小,则正反应为吸热反应 |
| D.达到平衡时,X与Y 的浓度相等 |
一定条件下,可逆反应N2+3H2 2NH3 ΔH<0达到平衡,当单独改变下述条件后,有关叙述错误的是
2NH3 ΔH<0达到平衡,当单独改变下述条件后,有关叙述错误的是
| A.加催化剂,v(正)、v(逆)都发生变化,且变化的倍数相等 |
| B.加压,v(正)、v(逆)都增大,且v(正)增大的倍数大于v(逆)增大的倍数 |
| C.降温,v(正)、v(逆)都减小,且v(正)减小的倍数大于v(逆)减小的倍数 |
| D.增大氮气的浓度,v(正)、v(逆)都增大,且v(正) 增大倍数大于v(逆)增大倍数;N2转化率减小,H2转化率增大 |
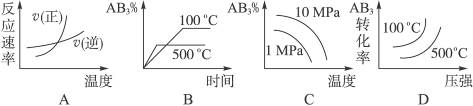
对于可逆反应2AB3(g) 2A(g) + 3B2(g) ΔH>0 下列图象不正确的是
2A(g) + 3B2(g) ΔH>0 下列图象不正确的是