已知某温度、压强下的气体摩尔体积为55.20 L·mol-1,在该条件下有1 mol气体X发生如下反应并达到平衡:2X(g) mY(g)+Z(g),测得混合气体中X的体积分数为55.80%,混合气体的总质量为46.00 g,混合气体的密度为0.72 g·L-1。则平衡混合气体的平均相对分子质量为( )
mY(g)+Z(g),测得混合气体中X的体积分数为55.80%,混合气体的总质量为46.00 g,混合气体的密度为0.72 g·L-1。则平衡混合气体的平均相对分子质量为( )
| A.58.80 | B.46.00 | C.39.74 | D.16.13 |
下表为元素周期表的一部分,其中X、Y、Z、W 为短周期元素,W 元素的核电荷数为X 元素的2倍。下列说法不正确的是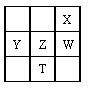
| A.X、W、Z 元素的气态氢化物的热稳定性均依次递减 |
| B.Y、Z、W 元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增 |
| C.液态WX3气化均需克服分子间作用力 |
| D.根据元素周期律,可以推测T 元素的单质具有半导体的特性 |
下列关于有机化合物的说法正确的是
| A.乙酸和乙酸乙酯可用Na2CO3溶液加以区别 | B.戊烷(C5H12)有两种同分异构体 |
| C.乙烯、聚氯乙烯和苯分子中均含有碳碳双键 | D.糖类、油脂和蛋白质均可发生水解反应 |
下列关于有机物的叙述正确的是
| A.乙醇不能发生取代反应 | B.C4H10有三种同分异构体 |
| C.氨基酸、淀粉均属于高分子化合物 | D.乙烯和甲烷可用溴的四氯化碳溶液鉴别 |
短周期元素X、Y、Z、W在元素周期表中的位置如下图所示,若W原子最外层电子数是其内层电子总数的3/5。下列说法中,正确的是
| A.X只有一种氧化物 |
| B.气态氢化物的稳定性Z>W |
| C.原子半径由大到小排列顺序Z>Y>X |
| D.元素X是自然界中形成化合物种类最多的元素 |
面粉厂必须严禁烟火的主要原因是
| A.防止火灾发生 |
| B.防止污染面粉 |
| C.吸烟有害健康 |
| D.面粉颗粒极小,当其扩散在空气中与空气充分接触,一旦引发反应,极易发生爆炸 |