下图表示外界条件(温度、压强)的变化对下列反应的影响:L(s)+G(g) 2R(g);ΔH>0,则图中Y轴是指( )
2R(g);ΔH>0,则图中Y轴是指( )

| A.平衡混合气中R的质量分数 |
| B.平衡混合气中G的质量分数 |
| C.G的转化率 |
| D.L的转化率 |
下列有关物质性质的应用错误的是
| A.明矾水解生成Al(OH)3胶体,用作净水剂 |
| B.SO2具有漂白性,常用来漂白纸浆 |
| C.碳酸钠溶液显碱性,可用热的纯碱溶液除去金属器件表面油污 |
| D.氮气化学性质通常不活泼,可将炽热的镁粉可放在氮气中冷却 |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.遇苯酚显紫色的溶液:Na+、Al3+、Cl-、SCN- |
| B.使甲基橙变红色的溶液:K+、Mg2+、SO42-、NO3- |
| C.加入淀粉碘化钾溶液变蓝色的溶液:Na+、CO32-、HSO3-、OH- |
| D.由水电离产生的c(H+)=10-12 mol·L-1的溶液中:NH4+、SO42-、HCO3-、Cl- |
下列有关化学用语表示正确的是
A.乙烯的结构简式:CH2CH2
B.硫原子的结构示意图: 
C.基态18 8O的电子排布式:1s22s22p63s23p6
D.过氧化钠的电子式: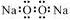
“碧水千河扬长帆,蓝天白云飘纸鸢”我们淮安市人民正在积极建设“碧水蓝天”的生态城市,下列措施中不合理的是
| A.限制化学工业发展,关停所有化工企业,消除污染源头 |
| B.积极推广太阳能、风能等新能源,减少化石燃料的使用 |
| C.加强城市生活污水脱氮除磷处理,遏制水体的富营养化 |
| D.禁止露天焚烧秸杆,推广秸秆沼气、发电、制酒精技术 |
实验测得 BeCl2为共价化合物,两个Be—Cl键间的夹角为180°。由此可见,BeCl2属于
| A.由极性键构成的极性分子 | B.由极性键构成的非极性分子 |
| C.由非极性键构成的极性分子 | D.由非极性键构成的非极性分子 |