有下列四种溶液:①盐酸;②氯化铁;③氢氧化钠;④碳酸钠。它们的pH分别为4,4,10,10,溶液中水的电离度为α1,α2,α3,α4,则下列关系正确的是
| A.α1=α2>α3=α4 |
| B.α2=α4>α1=α3 |
| C.α1=α2=α3=α4 |
| D.α1=α3>α2=α4 |
按图甲装置进行实验,实验结果如图乙所示。乙中横坐标x表示电路中通过电子的物质的量,纵坐标y表示反应物或生成物的物质的量,下列叙述不正确的是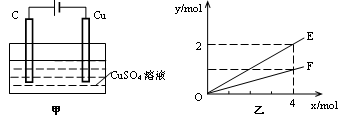
| A.E表示反应生成铜的物质的量 | B.E表示反应消耗水的物质的量 |
| C.F表示反应生成氧气的物质的量 | D.F表示反应生成硫酸的物质的量 |
将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s) 2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示:
2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示: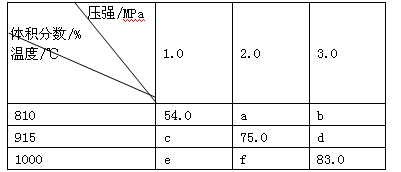
①b<f②810℃、1.0MPa时E的转化率约为37%
③该反应在高温条件下为自发反应④K(1000℃) <K(810℃)
上述①~④中正确的有
| A.4个 | B.3个 | C.2个 | D.1个 |
室温时,盐酸和硫酸的混合溶液20 mL,向混合物中逐滴加入0.05mol/LBa(OH)2溶液时,生成的BaSO4和pH的变化如图所示(不考虑溶液混合时体积的变化)。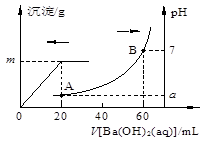
下列说法正确的是
| A.图中A点对应溶液的pH:a=1 |
| B.生成沉淀的最大质量m=2.33g |
| C.原混合液中盐酸物质的量浓度为0.1mol/L |
| D.当V[Ba(OH)2(aq)]=10mL时,发生反应的离子方程式为:Ba2+ + SO42-=BaSO4↓ |
根据下表提供的数据,判断下列离子方程式或化学方程式正确的是
| 化学式 |
电离常数 |
| HClO |
K=3×10-8 |
| H2CO3 |
K1=4×10-7K2=6×10-11 |
A.向Na2CO3溶液中滴加少量氯水:CO32-+ 2Cl2 + H2O = 2Cl-+ 2HClO + CO2↑
B.向NaHCO3溶液中滴加少量氯水:2HCO3-+ Cl2 = Cl-+ ClO-+ 2CO2↑ + H2O
C.向NaClO溶液中通少量CO2:CO2 + NaClO + H2O = NaHCO3 + HClO
D.向NaClO溶液中通过量CO2:CO2 + 2NaClO + H2O = Na2CO3 + 2HClO
恒温下,容积均为2L的密闭容器M、N中,分别有以下列两种起始投料建立的可逆反应3A(g)+ 2B(g) 2C(g)+ xD(s)的化学平衡状态,相关数据如下:M:3molA、2molB;2min;达到平衡,生成D1.2mol,测得从反应开始到平衡C的速率为0.3mol/Lmin。N:2molC、ymolD;达到平衡时c(A)=0.6mol/L。下列推断的结论中不正确的是
2C(g)+ xD(s)的化学平衡状态,相关数据如下:M:3molA、2molB;2min;达到平衡,生成D1.2mol,测得从反应开始到平衡C的速率为0.3mol/Lmin。N:2molC、ymolD;达到平衡时c(A)=0.6mol/L。下列推断的结论中不正确的是
A.x=2
B.平衡时M中c(A)=0.6mol/L
C.y<0.8
D.M中B的转化率与N中C的转化率之和为1