A H2SO4(aq) +2NaOH(aq) = NaA2SO4(aq)+ 2H2O(1)
B 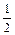 H2SO4(aq) +
H2SO4(aq) +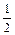 Ba(OH)2(aq) =
Ba(OH)2(aq) = 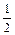 BaSO4(s)+ H2O(1)
BaSO4(s)+ H2O(1)
C HCl(aq) +NaOH(aq) =" NaCl(aq)+" H2O(1)
D HCl(aq) + NH3 H2O (aq) = (NH4Cl (aq) + H2O(1)
解析:由中和热的定义知,生成物必须为1 mol H2O放出的热量才可能是中和热,则A错误。由于B中除了有H2O生成外,还有BaSO4沉淀,反应热大于中和热。B项错误。D项中的氨水为弱电解质,所以反应热小于中和热。
答案:C
在由水电离出的c(H+)=×10-13 mol·L-1的溶液中一定大量共存的离子组是()
| A.Fe2+, Na+, NO3-, Cl- | B.Ba2+,Na+, NO3-,Cl- |
| C.SO42-,S2O32-,NH4+,Na+ | D.Mg2+,Na+,Br-,AlO2- |
已知H2(g)+1/2O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1下列说法中不正确的是( )
| A.H2的燃烧热为241.8 kJ·mol-1 |
| B.2H2(g)+O2(g)===2H2O(g)ΔH=-483.6 kJ·mol-1 |
| C.1 mol H2完全燃烧生成液态水放出的热量大于241.8 kJ |
| D.断裂1 mol H2O的化学键吸收的总能量大于断裂1 mol H2和0.5 mol O2的化学键所吸收的总能量 |
下列属于电解质的是:()
| A.硫酸溶液 | B.食盐晶体 | C.金属铜 | D.氨气 |
下列电离方程式书写不正确的是()
A.Al(OH)3 Al3++3OH- Al3++3OH- |
B.NaHCO3 ="==" Na++HCO3-HCO-3 H++CO32 - H++CO32 - |
| C.Na2SO4=2Na++SO42- | D.HF H++F- H++F- |
下列金属在一定条件下能够与水反应,且生成金属氧化物的是
| A.Na | B.Mg | C.Fe | D.Cu |