CO(g)+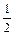 O2(g) = CO2(g);DH =-282.57 kJ/mol
O2(g) = CO2(g);DH =-282.57 kJ/mol
C(s) + 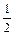 O2(g) = CO(g);DH =-110.3
O2(g) = CO(g);DH =-110.3 5 kJ
5 kJ /mol
/mol
与这些C完全燃烧相比,损失的热量为( )
| A.-784.92 kJ kJ | B.274.3 kJ | C.784.92 kJ | D.489.4 kJ |
解析:由盖斯定律可得,碳不完全燃烧损失的热量为生成的CO完全燃烧放出的热量。所以损失的热量为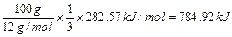
答案:C
下列实验叙述或操作正确的是
A.将AlCl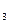 溶液加热蒸干可得无水AlCl 溶液加热蒸干可得无水AlCl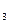 |
| B.用25 mL碱式滴定管量出14.80 mL的Na2CO3溶液 |
| C.在中和滴定的实验过程中,目光应注视滴定管中的液面 |
| D.用蒸馏水润湿的pH试纸测0.1mol/L的醋酸溶液的pH |
常温下0.1mol·L-1醋酸溶液的pH=a,下列能使溶液pH=(a+1)的措施是
| A.将溶液稀释到原体积的10倍 |
| B.加入适量的醋酸钠固体 |
| C.加入等体积0.2 mol·L-1盐酸 |
| D.适当提高溶液的温度 |
下列有关工业生产的叙述错误的是
| A.合成氨工业用铁触媒作催化剂,可加快正、逆反应速率 |
| B.合成氨工业对原料气进行压缩,可增大原料气的转化率 |
| C.硫酸工业中,采取通入适当过量的空气,以提高SO2的转化率 |
| D.硫酸工业中,在催化反应室安装热交换装置可利用SO3转化为H2SO4时放出的热量 |
向三份0.1mol/L NH4Cl中分别加入少量CH3COOK固体、FeCl2固体、氨气(忽略溶液体积变化),则NH4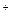 浓度的变化依次为
浓度的变化依次为
| A.增大、减小、减小 |
| B.减小、增大、减小 |
| C.减小、增大、增大 |
| D.增大、减小、增大 |
在由水电离出的c(OH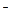 ) = 1×10
) = 1×10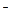 13mol·L-1的溶液中,下列各组离子一定不能大量共存的是
13mol·L-1的溶液中,下列各组离子一定不能大量共存的是
A.Na+、NH4+、NO3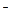 、CO32 、CO32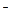 |
B.K+ 、I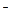 、Mg2+、SO42- 、Mg2+、SO42- |
C.Na+、Ba2+、OH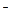 、NO3 、NO3 |
D.C1 、K+ 、NO3 、K+ 、NO3 、SO32 、SO32 |