某学生用邻苯二甲酸氢钾 ,式量为204.0)测定NaOH溶液的浓度,若每次都精确取用邻苯二甲酸氢钾为0.2040g.滴定终点时溶液的pH约为9.1(pH计测量),滴定时用酚酞做指示剂,用待测NaOH溶液滴定邻苯二甲酸氢钾,该生进行三次实验,每次消耗氢氧化钠溶液的体积如下表!
,式量为204.0)测定NaOH溶液的浓度,若每次都精确取用邻苯二甲酸氢钾为0.2040g.滴定终点时溶液的pH约为9.1(pH计测量),滴定时用酚酞做指示剂,用待测NaOH溶液滴定邻苯二甲酸氢钾,该生进行三次实验,每次消耗氢氧化钠溶液的体积如下表!
| 实验编号 |
邻苯二甲酸氢钾质量(g) |
待测NaOH溶液体积(mL) |
| l |
0.2040 |
23.20 |
| 2 |
0.2040 |
19.95 |
| 3 |
0.2040 |
20.05 |
(1)计算NaOH溶液的物质的量浓度
(2)该学生测定出来的NaOH溶液的物质的量浓度高于其实际值,造成该结果的原因可能是_________.
| A.盛放邻苯二甲酸氢钾的锥形瓶未用待装液润洗 |
| B.读消耗NaOH溶液的体积时,滴定前仰视,滴定后俯视 |
| C.滴速太快没来得及观察就已经变色 |
| D.配制NaOH溶液时,NaOH固体中可能混有KOH |
(8分)一个重100g的洁净烧瓶中,加入两种饱和一元醛A和B的混合液2.55g,向混合液中加入足量的银氨溶液,并水浴加热,经充分反应后,过滤、仔细洗涤、干燥,称得瓶和固体质量共110.8g。已知B比A的相对分子质量大14。求:
(1)写出A和B的结构简式;(2)求A和B的物质的量之比。
在有机溶剂里若m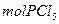 跟m
跟m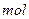
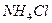 定量地发生完全反应,生成
定量地发生完全反应,生成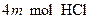 ,同时得到一种白色固体R。R的熔点为113℃,在减压下50℃即可升华,测得R的蒸气密度为折算成标准状况下
,同时得到一种白色固体R。R的熔点为113℃,在减压下50℃即可升华,测得R的蒸气密度为折算成标准状况下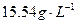 。试回答:
。试回答:
(1)通过计算推导R的化学式。
(2)分子结构测定表明,R分子为环状,且同种元素的原子在R分子中化合价相同,用单键“—”和双键“=”把分子里的原子连起来,写出R分子的结构式。
(8分)某元素X的碳酸氢盐 [X(HCO3)2] 在高温下完全分解的产物都是氧化物,现取3.24g这种碳酸氢盐高温完全分解后得到1.12g固体,又知X的原子核里有20个中子。
(1)通过计算确定X是什么元素,并写出它在元素周期表中的位置;
(2)写出X的单质与水反应的化学方程式,已知该元素的金属性比钠强,但其单质与水反应没有钠那样剧烈,试分析其原因。
有若干克某金属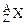 ,含中子总数为3.5×6.02×1023,同质量的该金属和足量稀H2SO4反应共有0.2mol电子发生转移,生成6.02×1022个阳离子
,含中子总数为3.5×6.02×1023,同质量的该金属和足量稀H2SO4反应共有0.2mol电子发生转移,生成6.02×1022个阳离子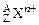 ,这些阳离子共有3.0×6.02×1023个质子。试求z、n和A值。
,这些阳离子共有3.0×6.02×1023个质子。试求z、n和A值。
在由铜片、锌片和200 mL稀硫酸组成的原电池中,若锌片只发生电化学腐蚀,当在铜片上放出3.36 L(标准状况)的H2时,硫酸恰好用完,则:
①产生这些气体消耗的锌的质量是多少?
②通过导线的电子的物质的量是多少?
③原稀硫酸的物质的量浓度是多少?(3分)