已知甲为恒温恒压容器,乙为恒温恒容容器。两容器中均充入1mol N2、3mol H2,初始时两容器的温度体积相同。一段时间后反应达到平衡,为使两容器中的N2在平衡混合物的物质的量分数相同,下列措施中可行的是
| A.向甲容器中充入一定量的氦气 |
| B.向乙容器中充入一定量的NH3气体 |
| C.升高乙容器的温度 |
| D.增大甲容器的压强 |
化学无处不在,下列与化学有关的说法正确的是( )
| A.液氨汽化时能吸收大量的热,故可用作制冷剂 |
| B.SO2能漂白纸浆等,故可广泛用于食品的漂白 |
| C.味精的主要成分是蛋白质,烧菜时可加入适量 |
| D.氢氟酸可用于雕刻玻璃制品,这是利用酸的通性 |
某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结,其中正确的是
| A.pH=1和pH=2的盐酸,c(H+)之比为1:2 |
| B.物质A三态间的转化如下:A(g)→A(1)→A(s),则该转化过程中△S<O |
| C.pH=13的强碱溶液,加水稀释后,溶液中所有离子的浓度均变小 |
| D.pH=9的CH3COONa溶液和pH=9的NH3.H2O溶液,两溶液中水的电离程度相同 |
下列药品和装置合理且能完成相应实验的是

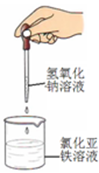
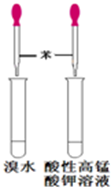
ABC D
| A.喷泉实验 | B.实验室制取并收集氨气 |
| C.制备氢氧化亚铁 | D.验证苯中是否含有碳碳双键 |
下列说法正确的是
| A.某粒子的电子数等于质子数,则该粒子可能是一种分子或一种离子 |
| B.构成单质的分子中一定含有共价键 |
| C.溶液和胶体的本质区别是有无丁达尔效应 |
| D.化学变化不产生新元素,产生新元素的变化不是化学变化 |
下列关于甲、乙、丙、丁四个图像的说法中,正确的是
| A.图甲表示向乙酸溶液中通入氨气,此过程中溶液导电性的变化 |
| B.由图乙可知,若除去CuSO4溶液中的Fe3+可采用向溶液中加入适量CuO至pH在4左右 |
| C.图丙表示25℃时,用0.1 mol/L盐酸滴定20mL 0.1 mol/L氨水,溶液的pH随加入盐酸体积的变化 |
| D.图丁表示向Al2(SO4)3溶液中滴入NaOH溶液,生成Al(OH)3沉淀的量随NaOH溶液体积的变化 |